
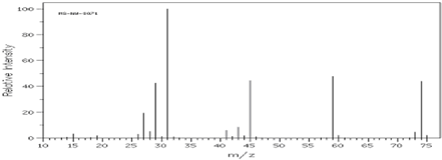
| A. | 74 | B. | 31 | C. | 59 | D. | 45 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
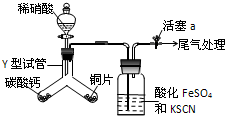 (1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
(1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何溶液中,c(H+)×c(OH-)=1.0×10-14 | |
| B. | pH=0的溶液呈中性 | |
| C. | 酸性溶液中,c(H+)越大,酸性越强 | |
| D. | 酸性溶液中没有OH-,碱性溶液里没有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后的最高温度 |
| ① | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ④ | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,0.02 mol•L-1的醋酸溶液与0.01 mol•L-1的醋酸溶液中的c(H+)之比小于2:1 | |
| B. | 相同温度下,0.1 mol•L-1 (NH4)2SO4溶液与0.1 mol•L-1NH4NO3溶液中c(NH4+)之比大于2:1 | |
| C. | 在0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 | |
| D. | 40℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com