
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
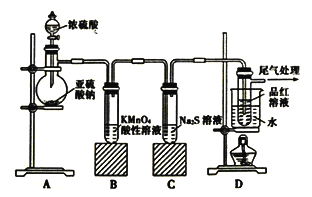
请回答下列问题:
(1)实验过程中,装置B中的现象是________________,原因是(用离子方程式表示)_____________。
(2)实验过程中,装置C中现象说明SO2具有的性质是_____________________。
(3)装置D中品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,可观察到的现象为__________。
(4)是否能将分液漏斗中的浓H2SO4换作浓HNO3,理由是_________________________。
【答案】 溶液紫色逐渐退去 5SO2+2MnO4-+2H2O=4H++2Mn2++5 SO42- 氧化性 溶液恢复为红色 不能,因为浓HNO3可将亚硫酸钠氧化为硫酸钠,得不到SO2气体
【解析】(1)二氧化硫和高锰酸钾溶液发生氧化还原反应生成硫酸,高锰酸钾溶液溶液的颜色褪去,高锰酸钾被还原生成锰离子,反应的两种方程式为5SO2+2MnO4-+2H2O=4H++2Mn2++5 SO42-,故答案为:溶液紫色逐渐退去;5SO2+2MnO4-+2H2O=4H++2Mn2++5 SO42-;
(2)二氧化硫能和硫化氢发生反应生成淡黄色沉淀,所以C中出现黄色浑浊,该反应中,二氧化硫中的硫元素化合价由+4价变为0价,所以二氧化硫得电子而作氧化剂,体现氧化性,故答案为:氧化性;
(3)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热无色溶液时,溶液又变为红色,故答案为:溶液恢复为红色;
(4)浓HNO3可将亚硫酸钠氧化为硫酸钠,得不到SO2气体,因此不能将分液漏斗中的浓H2SO4换作浓HNO3,故答案为:不能,因为浓HNO3可将亚硫酸钠氧化为硫酸钠,得不到SO2气体。


科目:高中化学 来源: 题型:
【题目】一定温度下,对于可逆反应A2(g)+3B2(g)![]() 2AB3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是
2AB3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是
A.恒容容器内混合气体的密度不再变化
B.AB 3的生成速率与B2的生成速率之比为2∶3
C.恒压容器内混合气体的总物质的量不再变化
D.单位时间内断裂a mol A≡A键,同时断裂6a mol A—B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,右向所得硝酸铜溶液中加入5mol·L-1 NaOH溶液至Cu2+恰好完全沉淀, 则消耗 NaOH溶液的体积是
A. 15mL B. 30 mL C. 45 mL D. 60 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室保存下列试剂,其中保存方法和理由描述都正确的是 ( )
编号 | 试剂 | 保存方法 | 理由 |
A | 白磷 | 保存在煤油中 | 防止与空气中水、氧气接触发生反应 |
B | 液溴 | 密封保存在细口瓶中 | 防止升华 |
C | 氯水 | 存放在磨口玻璃塞的棕色瓶中 | 避免见光分解 |
D | 氢氟酸 | 存放在磨口玻璃塞的广口瓶中 | 防止挥发 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的工业原料。
(1)标准状况下,将500L氨气溶与水形成1L氨水,则此氨水的物质的量浓度为______mol/L(保留三位有效数字),该氨水最多能吸收二氧化硫的体积为_________。
(2)氨的催化氧化是重要的工业生产,此反应将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__________________。下列反应中的氨与氨催化氧化中的氨性质相同的是________________。
A.2Na+2NH3=2NaNH2+H2↑
B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O
D.HNO3+NH3=NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第二周期元素
B.位于元素周期表中第三周期ⅢA族的元素
C.原子最外层电子排布为2s22p6的元素
D.原子最外层电子排布为2s22p5的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com