
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
A.0.3 mol NO2、0.1 mol NO B.0.3 mol NO、0.1 mol NO2
C.0.6 mol NO D.0.3 mol NO2
A
【解析】
试题分析:15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成硝酸铁、硝酸铜,向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀为氢氧化铁、氢氧化铜的总质量,则根据原子守恒可知沉淀中氢氧根的质量=25.4g-15.2g-10.2g,因此氢氧根离子的物质的量=10.2g÷17g/mol=0.6molmol。根据电荷守恒可知,金属提供电子物质的量就等于金属阳离子结合的氢氧根离子的物质的量,所以金属提供电子物质的量为0.6mol,则A、若生成0.3mol NO2、0.1mol NO,则转移电子为0.3mol×(5-4)+0.1mol×(5-2)=0.6mol,电子转移守恒,A正确;B、若生成0.3mol NO、0.1mol NO2,则转移电子为0.3mol×(5-2)+0.1mol×(5-4)=1mol,电子转移不守恒,B错误;C、若生成0.6mol NO,则转移电子为0.6mol×(5-2)=1.8mol,电子转移不守恒,C错误;D、若生成0.3mol NO2,则转移电子为0.3mol×(5-4)=0.3mol,电子转移不守恒,D错误,答案选A。
考点:考查金属与硝酸反应的有关计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年山东省济宁市高三上学期期中化学试卷(解析版) 题型:选择题
下表中关于物质分类的正确组合是
类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO | CuO | H2SO4 | NH3·H2O | Na2S |
B | CO2 | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
下列各反应的离子方程式中,正确的是
A.铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
B.硫酸铝溶液中加入过量的氨水:Al3++3 OH-===Al(OH)3↓
C.铁片放入过量的稀硝酸中:3Fe+8H++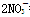 ===3Fe2++2NO↑+4H2O
===3Fe2++2NO↑+4H2O
D.将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O===2Al(OH)4-+3H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:选择题
下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图。

下列说法正确的是
A.该电化腐蚀为析氢腐蚀
B.图中生成铁锈最多的是C区域
C.A区域比B区域更易腐蚀
D.铁闸中的负极的电极反应:Fe-2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:填空题
(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是 ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法正确的是
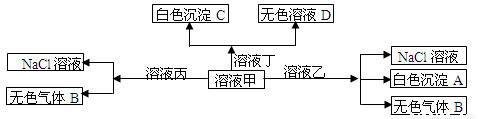
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42—
C.在甲中滴加丁开始反应的离子方程式:HCO3—+ Ba2++OH—= BaCO3↓+ H2O。
D.白色沉淀A可能溶解在溶液D中。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
T1温度下,反应2SO2(g)+O2(g)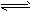 2SO3(g) △H<0的平衡常数K=532.4。
2SO3(g) △H<0的平衡常数K=532.4。
(1)该反应平衡常数的表达式为K= ,T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)=0.0600 mol·L-1,c(O2)=0.400 mol·L-1,c(SO3)=2.000mol·L-1,此时反应进行的方向为 。
(2)该反应△S 0,升高温度,平衡常数 (填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
平衡时n(SO3)/mol | 1 | m |
反应物的转化率 | ?1 | ?2 |
①下列能说明T2温度下甲容器中上述反应已达到平衡状态的是 。
A.SO2、O2、SO3的物质的量浓度之比为2:1:2
B.容器内气体压强不再变化
C.单位时间内2v(SO2)消耗= v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,?1+?2 1(填“>”“=”或“<”),T1 T2(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数,则关于热化学方程C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= -1300kJ·mol-1的说法中,正确的是
A.有10NA个电子转移时,放出1300kJ的能量
B.有44.8LCO2气体生成时,放出1300kJ的能量
C.有NA个水分子生成且为液体时,吸收1300kJ的能量
D.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(14分)2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式为 。
2CO2(g)+ N2(g) △H<0同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式为 。
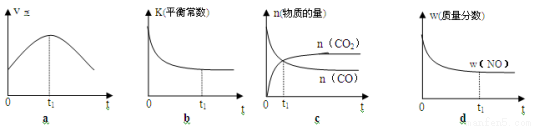
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
时间/min | CO2(mol·L-1) | H2(mol·L-1) | CO(mol·L-1) | H2O(mol·L-1) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率为 ;
②第5—6min,平衡移动的可能原因是 ;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
2NO2(g)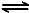 N2O4(g) △H=-56.9 kJ·mol-1
N2O4(g) △H=-56.9 kJ·mol-1
H2O(g) = H2O(l) △H = -44.0 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是 mol
(6)在一定条件下,也可以用H2处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com