
某化学兴趣小组的同学利用所示实验装置进行实验(图中a、b、c表示止水夹)。
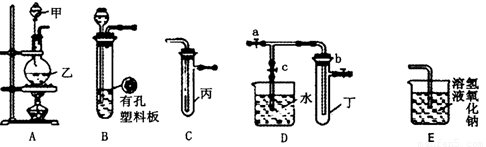
请按要求填空:
(1)利用B装置可制取的气体有__________(填2种)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:

请你评价实验Ⅱ结论是否合理?_____________;理由:______________。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)_____________。
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为____________________________。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是_______________________。
③试管丁中的NO2与一定量的O2混合充满后倒插水中,试管9/10充满水,则原试管丁中的混合气体平均相对分子质量可能为_________。(只填一种即可,保留二位小数)
(1)H2、CO2、H2S等;(2)不合理;因为制取的氯气中含有的HCl气体,HCl溶于水后也能与NaHCO3粉末反应产生气泡;(3)在甲、乙、丙中分别装入浓HCl、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液有无色变为橙色,证明Cl2的氧化性强于Br2;(4)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;双手握热试管丁,使2NO2与水接触; 42.08或44.04
【解析】
试题分析:(1)利用该装置制取的气体应该是:块状固体和液体反应制取气体;反应不需要加热,制取的气体难溶解于水。可以制取H2、 CO2 、H2S等。(2)(2)不合理;因为制取的氯气中含有的HCl气体,HCl溶于水后也能与NaHCO3粉末反应产生气泡;应该先将HCl除去再进行实验就可以了。(3)氧化性强的能把氧化性弱的物质从它的化合物中置换出来。在甲、乙、丙中分别装入浓HCl、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液有无色变为橙色,证明Cl2的氧化性强于Br2;(4)①铜和浓硝酸反应的方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O; ②,使烧杯中的水进入试管丁的操作是双手握热试管丁,使2NO2与水接触;③剩余气体可能是O2也可能是NO。假设试管容积是10V,若剩余气体是O2。则根据4NO2+O2+2H2O=4HNO3,可知剩余氧气为V,反应9V其中NO2是(4/5)×9V,O2=(1/5)×9V,所以混合气体的平均相对分子质量是[(4/5)×9V×46+{10V-(4/5)×9V}×32]÷10V=42.08。若剩余气体是NO根据3NO2+H2O=2HNO3+NO相当于剩余NO23V。反应消耗气体7V。根据4NO2+O2+2H2O=4HNO3可知氧气体积为(1/5)×7V. NO2体积为{10V-(1/5)×7V }.混合气体平均相对分子质量为:[{10V-(1/5)×7V }×46+(1/5)×7V×32] ÷10V=44.04.
考点:考查气体的制备及NO2与O2混合气体与水反应的情况的计算的知识。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 | 实验操作 | 现象 | 结论 |
| I | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物具有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验 序号 |
实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气体产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
| ② | 向新制得到的Na2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
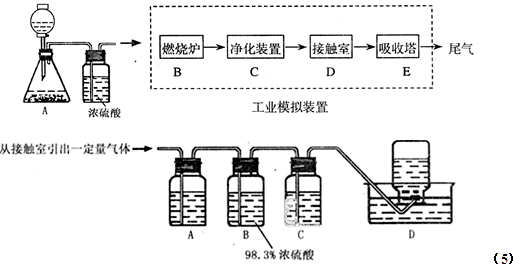
| ||
| ||
| ||
| ||
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com