

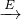 D可知,A为H2O2,E为MnO2,由固体B
D可知,A为H2O2,E为MnO2,由固体B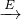 D+F,由(1)B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1molB转移5mol电子,B中氯元素化合价为+5,则B为KClO3,F为KCl,
D+F,由(1)B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1molB转移5mol电子,B中氯元素化合价为+5,则B为KClO3,F为KCl,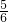
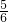 :1=5:1;
:1=5:1; 2H2O+O2↑,制得2molO2时,转移电子数为2mol×2×[0-(-1)]=4mol;
2H2O+O2↑,制得2molO2时,转移电子数为2mol×2×[0-(-1)]=4mol; H2↑+Cl2↑+2OH-;
H2↑+Cl2↑+2OH-; H2↑+Cl2↑+2OH-;c(K+)=c(A-)>c(OH-)=c(H+);
H2↑+Cl2↑+2OH-;c(K+)=c(A-)>c(OH-)=c(H+);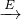 D可知,A为H2O2,E为MnO2,由固体B
D可知,A为H2O2,E为MnO2,由固体B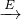 D+F,由(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1molB转移5mol电子,B中氯元素化合价为+5,则B为KClO3,F为KCl.
D+F,由(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1molB转移5mol电子,B中氯元素化合价为+5,则B为KClO3,F为KCl.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体。

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1 mol B转移5 mol 电子,则B与浓盐酸反应的化学方程式为 ,生成的氧化产物与还原产物的物质的量之比为 ;
(2)固体C与水反应生成D的化学方程式为 ;
利用右上图所示的实验装置进行C与水的反应,检验导管出口气体的方法为 ;
 烧杯中的现象为 ;
烧杯中的现象为 ;
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式 ;
若将浓度为 c1 的M溶液与0.2 mol?L-1 的一元酸HA等体积混合,所得溶液pH = 7,则
c1 (填“≥”、“=”或“≤”)0.2 mol?L-1 ,溶液中离子浓度的大小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体。


(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1 mol B转移5 mol 电子,则B与浓盐酸反应的化学方程式为 ,生成的氧化产物与还原产物的物质的量之比为 ;
(2)固体C与水反应生成D的化学方程式为 ;利用右上图所示的实验装置进行C与水的反应,检验导管出口气体的方法为 ;烧杯中的现象为 ;
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式 ;
若将浓度为 c1 的M溶液与0.2 mol·L-1 的一元酸HA等体积混合,所得溶液pH = 7,则
c1 (填“≥”、“=”或“≤”)0.2 mol·L-1 ,溶液中离子浓度的大小关系为 。
查看答案和解析>>
科目:高中化学 来源:2011年四川省广安市武胜县高考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com