

分析 由实验流程可知,9.08g固体X与过量盐酸反应生成蓝色溶液,则溶液中含有Cu2+,因铜与稀盐酸不反应,则一定含有Fe2O3,首先发生Fe2O3+6H+═2Fe3++3H2O,然后发生Cu+2Fe3+═2Fe2++Cu2+,只有Cu、SiO2与稀盐酸不反应,则B为SiO2,加入过量NaOH,剩余固体C应为Cu,以此解答(1)、(2);
(3)为进一步确定上述混合物X的成分,另取9.08g X进行如下实验.
①加入足量的NaOH溶液,过滤,将滤渣在氮气气流中干燥得固体m g.
②向滤渣中加入过量盐酸,过滤,将滤渣在氮气气流中干燥得固体n g.
上述实验操作中,没有洗涤后称量固体,则固体的质量偏大,以此来解答.
解答 解:由实验流程可知,9.08g固体X与过量盐酸反应生成蓝色溶液,则溶液中含有Cu2+,因铜与稀盐酸不反应,则一定含有Fe2O3,首先发生Fe2O3+6H+═2Fe3++3H2O,然后发生Cu+2Fe3+═2Fe2++Cu2+,只有Cu、SiO2与稀盐酸不反应,则B为SiO2,加入过量NaOH,剩余固体C应为Cu,
(1)由上述分析可知,I中发生的离子反应为Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,
故答案为:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+;
(2)由上述分析可知,一定含Cu、Fe2O3、SiO2,反应Ⅱ的化学反应为SiO2+2NaOH═Na2SiO3+H2O,
故答案为:Cu、Fe2O3、SiO2;SiO2+2NaOH═Na2SiO3+H2O;
(3)过滤后沉淀应洗涤,若没有洗涤,表面附着离子,则固体质量偏大,可知上述①②由于缺少洗涤步骤,使得测定的质量m、n均偏高,故答案为:洗涤;偏高.
点评 本题考查混合物成分的推断,为高频考点,注意根据反应现象判断存在的物质,注意合理分析题中数据,把握元素化合物知识及实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y). | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | X与其余三种元素之间形成的核外电子总数为10的微粒只有2种 | |
| D. | H2Z的熔点比H2W高,是因为它们的晶体类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成较多的白色沉淀 | |
| B. | 排除SO42-以外的其它阴离子及Ag+的干扰 | |
| C. | 形成的沉淀纯度更高 | |
| D. | 排除Ba2+以外的其它阳离子的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
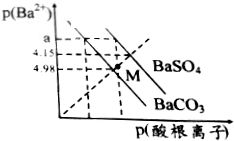 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,每转移1mol电子,生成11.2L的H2 | |
| B. | 1molMg与足量的N2完全反应时,转移的电子数为3NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数为0.2NA | |
| D. | 常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Ca2+)增大 | B. | c(Ca2+)不变 | C. | n(OH-)增大 | D. | c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中W的最高价氧化物对应水化物的酸性最强 | |
| B. | 氢化物的热稳定性:HnY>HnW | |
| C. | Y和X、Z和X组成的常见化合物中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rW>rZ>rY>rX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com