
【题目】150℃时,11.6g CO2和H2O的混合气体与足量的Na2O2充分反应后,固体物质的质量增加了3.6g,则原混合气体中CO2与H2O的物质的量之比是( )
A.1:4B.3:11C.1:11D.21:22
【答案】A
【解析】
150℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=![]() 计算生成O2的物质的量,根据方程式可知n(混合气体)=2(O2),假设混合物中CO2和水蒸气的物质的量分别为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算。
计算生成O2的物质的量,根据方程式可知n(混合气体)=2(O2),假设混合物中CO2和水蒸气的物质的量分别为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算。
向足量的固体Na2O2中通入11.6gCO2和H2O,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,所以n(O2)=18g÷32g/mol=0.25mol,假设混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则根据方程式2Na2O2+2CO2=Na2CO3+O2可知反应产生O2物质的量是0.5x,根据2Na2O2+2H2O=4NaOH+O2↑可知H2O反应产生O2的物质的量是0.5y,所以0.5x+0.5y=0.25, 44x+18y=11.6,解得x=0.1mol,y=0.4mol,所以原混合气体中CO2和H2O的物质的量之比n(CO2):n(H2O)=1:4,故合理选项是A。


科目:高中化学 来源: 题型:
【题目】用常见烃A与某些烃的含氧衍生物可以制备PI(聚2-甲基-1,3-丁二烯)和PVB塑料。流程如图:
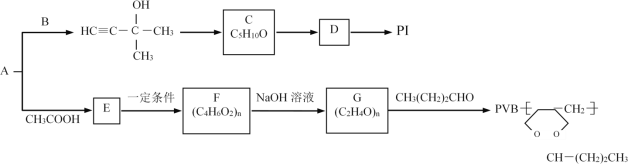
完成下列填空:
(1)A的名称是___,B的结构简式为___,C→D的反应条件是___,D→PI的反应类型是___。
(2)E中所含官能团的名称是___,写出符合下列条件的E的所有同分异构体的结构简式:___。
a.能发生银镜反应和水解反应
b.能与氢气发生加成反应
c.分子结构中含有一个甲基
(3)写出F→G的化学反应方程式:___。
(4)试用电石和乙醛等原料(无机试剂任选)制取1,3-丁二烯(合成正丁橡胶的原料),写出合成路线___。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池如图所示,下列关于该电池说法正确的是

A.a电极发生还原反应,做原电池的正极
B.b电极反应式为:2NO3-+10e-+12H+=N2↑+6H2O
C.H+由右室通过质子交换膜进入左室
D.标准状况下,电路中产生6moLCO2同时产生22.4L的N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称是_______,B含有的官能团是_______________。
(2)①的反应类型是____________,⑦的反应类型是________________。
(3)C和D的结构简式分别为______________、_________________。
(4)异戊二烯分子中最多有________个原子共平面,顺式聚异戊二烯的结构简式为___________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体__________(填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.9 g Mg、Al合金溶于一定物质的量浓度的HCl溶液400 mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀。如果加入一定量的NaOH溶液至沉淀量最大时,溶液的总体积刚好为合金溶解时体积的两倍,假设完全反应(不考虑体积变化),试求:
(1)生成的沉淀的最大值是多少_________?
(2)原合金中Mg的质量百分含量_________(计算结果保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。巴蜀中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制250mL上述浓度的消毒液:
①需要用托盘天平称量NaClO固体的质量为_______g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________。
(3)实验过程中下列操作或说法不正确的是_____。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
(4)经过查阅资料,测定所配消毒液中NaClO的物质的量浓度的方法如下:准确取出10.00mL消毒液稀释至1000.00mL,量取稀释液20.00mL于锥形瓶中,加入过量的NaI溶液,用足量的醋酸酸化,充分反应后向溶液中滴加0.0500 mol/L Na2S2O3溶液,完全反应时消耗Na2S2O3溶液30.40mL。反应过程中的相关化学方程式为: ![]()
![]() ,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
Ⅱ、某工厂的工业废水中含有大量FeSO4,较多的CuSO4和少量的Na2SO4,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。请根据下列流程,完成实验方案(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液)
(1)操作a的名称为____,所需的玻璃仪器有_____。
(2)固体E的成分为____(填化学式),加入的试剂④为_________。
(3)加入试剂①的目的是__________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为_______,过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式为:MnO4-+NO2-+ →Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中NO2-被还原B.反应过程中溶液的酸性增强
C.生成1 mol NaNO3需消耗0.4 mol KMnO4D.方程式中缺少的粒子是OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com