
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=﹣49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=﹣49.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
请回答:
①c1 c2(填“>”、“<”或“=”);a = 。
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是 mol/(L·s)。
(2)压强为p1时 ,向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g) CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:
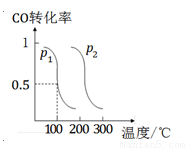
①该反应属于 (填“吸”或“放”)热反应;p1 p2(填“>”、“<”或“=”)。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)。




a b c d
科目:高中化学 来源:2016-2017学年青海省高一上月考一化学试卷(解析版) 题型:选择题
已知1.505×1023个X气体分 子的质量为8g,则X气体的摩尔质量是( )
子的质量为8g,则X气体的摩尔质量是( )
A.16g B.32g C.64g /mol D.32g /mol
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研模拟二化学试卷(解析版) 题型:实验题
钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
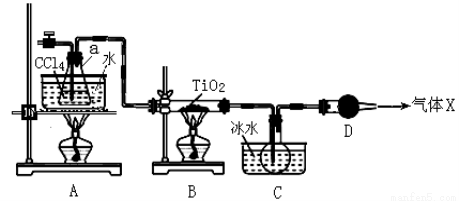
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
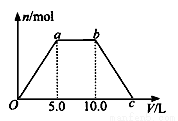
⑤ 若将反应过程中生成的气体X(足 量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届福建省龙岩市五校高三上学期期中化学试卷(解析版) 题型:选择题
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A.SO2 、 H2S B.NH3、 CO2 C.Cl2 、 CO2 D.SO2 、Cl2
查看答案和解析>>
科目:高中化学 来源:2017届福建省龙岩市五校高三上学期期中化学试卷(解析版) 题型:选择题
下列各组离子,在指定的环境中一定能大量共存的是( )
A.常温下,在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、NO3-、Na+
B.在能使石蕊变红色的溶液中:Na+、S2-、SO42-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Na+、NO3-、Cl-
D.常温下由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:简答题
卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的______________族。
(2)用电子式表示HCl的形成过程______________。
(3)依据上表,可以推测出:随着原子序数的递增,___________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:选择题
下列解释实验事实的方程式正确的是
A.用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH—=2AlO2—+H2O
B.铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
C.氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O=2Fe(OH)3
D.碳酸钠溶液呈碱性:CO32—+2H2O H2CO3+2OH—
H2CO3+2OH—
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市高一10月月考化学卷(解析版) 题型:选择题
N2与O2 的混合气体的密度对氢气的相对密度为14.5,则N2在混合气体中的质量分数为
A.72.4% B.75% C.50% D.80.5%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二10月月考化学卷(解析版) 题型:选择题
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com