
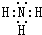 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.分析 短周期元素A、B、C、D、E的原子序数依次增大,①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M,则C为N元素,M为NH4NO3;②A的氧化物是生活中最常见液体,该液体应是水,结合原子序数可知,则A为H元素;A、E同主族,E的原子序数大于氮,则E为Na元素;C与B、D相邻,B、D原子序数均小于Na,可推知B为碳元素、D为O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3,则F为NH4HCO3,据此解答.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M,则C为N元素,M为NH4NO3;②A的氧化物是生活中最常见液体,该液体应是水,结合原子序数可知,则A为H元素;A、E同主族,E的原子序数大于氮,则E为Na元素;C与B、D相邻,B、D原子序数均小于Na,可推知B为碳元素、D为O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3,则F为NH4HCO3,
(1)C的气态氢化物为NH3,其电子式为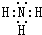 ,A为氢元素,周期表中位置是第一周期第ⅠA族,
,A为氢元素,周期表中位置是第一周期第ⅠA族,
故答案为: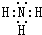 ;第一周期第ⅠA族;
;第一周期第ⅠA族;
(2)化合物E2D2为Na2O2,由钠离子与过氧根离子构成,阴阳离子个数比为1:2,F为NH4HCO3,含有离子键、共价键,
故答案为:1:2;离子键、共价键;
(3)NH4HCO3溶液与足量NaOH的稀溶液混合,反应生成碳酸钠与一水合氨,反应离子方程式为:2OH-+HCO3-+NH4+═CO32-+H2O+NH3•H2O,
故答案为:2OH-+HCO3-+NH4+═CO32-+H2O+NH3•H2O;
(4)C的气态氢化物为NH3,氯气与NH3相遇有白烟及N2生成,生成的白烟为NH4Cl,其化学反应方程式为3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
(5)N2H4空气燃料电池中,是还原剂,N2H4在正极发生氧化反应,氧气是氧化剂在负极发生氧化反应,在KOH溶液中该燃料电池的正极反应式为N2H4-4e-+4OH-═N2+4H2O,
故答案为:N2H4-4e-+4OH-═N2+4H2O.
点评 本题考查位置结构性质的应用,涉及常用化学用语、元素化合物性质、氧化还原反应、原电池等,难度中等,推断元素是解题的关键,(3)中离子方程式书写为易错点,注意氢氧根离子足量,铵根离子与碳酸氢根均反应,且为稀溶液,得到一水合氨.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
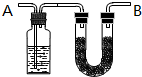 将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108.
将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含共价键的共价化合物一定是分子晶体,分子晶体一定含共价键 | |
| B. | 固态可以导电的是离子晶体和金属晶体 | |
| C. | 由原子构成的晶体一定是原子晶体,由分子构成的晶体一定是分子晶体 | |
| D. | 判定晶体为离子晶体还是分子晶体的方法是看其熔融态是否能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
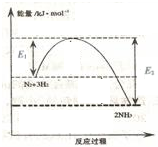 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com