
【题目】下列叙述中,错误的是
A. 在平衡体系 PCl5(g) ![]() PCl3(g) + Cl2(g) 中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
PCl3(g) + Cl2(g) 中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
B. CH3COOH与H18O—CH2CH3发生酯化反应是可逆反应,达到平衡后18O仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里
C. CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构
D. 在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃
【答案】D
【解析】
A.在平衡体系PCl5(g) ![]() PCl3(g) + Cl2(g) 中加入一定量的37Cl2,由于该反应为可逆反应,故一段时间后五氯化磷、三氯化磷和氯气这三种物质中都含有37Cl2,故不选A;
PCl3(g) + Cl2(g) 中加入一定量的37Cl2,由于该反应为可逆反应,故一段时间后五氯化磷、三氯化磷和氯气这三种物质中都含有37Cl2,故不选A;
B.酯化反应的实质是:酸脱羟基,醇脱氢,故CH3COOH与H18O—CH2CH3发生酯化反应,达到平衡后18O仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里,故不选B;
C.若甲烷是平面结构,则CH2Cl2会有两种结构(一种两个氯原子相邻,一种处于对角线位置不相邻)但CH2Cl2只有一种结构,说明甲烷不是平面结构,是以碳原子为中心的正四面体结构,故不选C;
D.在氧气中完全燃烧后生成物只有CO2和H2O的有机物可能是烃,也有可能是烃的含氧衍生物,如乙醇等,故选D;
答案:D


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
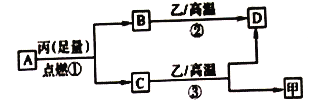
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们从蛋白质水解产物中分离出一种含有1个氮原子的氨基酸进行分析时,从0.19g该氨基酸得16mL的氮气(在标准状况下),试计算该氨基酸的含氮量和式量,假如19.95g该氨基酸可以和100mL1.5mol/L的Ba(OH)2溶液恰好完全反应,试推出该氨基酸的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+ 是反应性很强的正离子,是缺电子的,其电子式是__________________。
(2)CH3+ 中4个原子是共平面的,三个键角相等,键角应是_________(填角度)。
(3)(CH3)2CH+ 在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是_____________。
(4)(CH3)3C+ 去掉H+ 后将生成电中性的有机分子,其结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
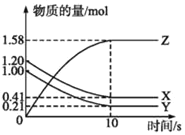
(1)写出该反应的化学方程式___________________
(2)下列叙述中不能说明上述反应达到平衡状态的是___________.
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是_____.
A 恒压时充入Ne B 适当升高温度
C 缩小容器的体积 D 选择高效催化剂.
II.一定温度下将3mol的A及3molB混合于2L的密闭
容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
求:(1)平衡时B的浓度=______mol/L。
(2)D的平均反应速率υ(D)=______mol/( L.min)。
(3)x=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com