
| A、KCl固体 |
| B、HCl气体 |
| C、KClO3溶液 |
| D、MgCl2溶液 |


科目:高中化学 来源: 题型:
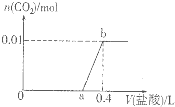 向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )| A、在0-a范围内,只发生中和反应 |
| B、ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O |
| C、a=0.2 |
| D、原混合溶液中NaOH与Na2CO3的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是离子化合物在离子方程式中都要以离子来表示 |
| B、离子互换反应总是向着溶液中离子浓度减小的方向进行 |
| C、酸碱中和反应的实质是H+和OH-结合生成水,故酸碱中和反应的离子方程式都是H++OH-=H2O |
| D、复分解反应必须具备离子反应生成的三个条件才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠和水反应:2Na2O2+2H2O=4Na++4OH-+O2↑ |
| B、用铜为电极电解饱和食盐水:2Cl-+2H2O=Cl2↑+H2↑+2OH- |
| C、在明矾溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓ |
| D、向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充入氦气 | B、分离除乙醇 |
| C、增大压强 | D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
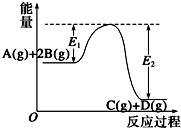
| A、该反应为吸热反应 |
| B、当反应达到平衡时,降低温度,A的转化率减小 |
| C、升高温度,平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D、加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75-85℃ | 500g?L-1 |
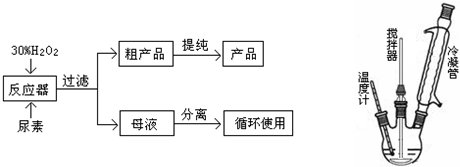
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com