
| A. | 化合物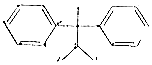 是苯的同系物 是苯的同系物 | |
| B. | 有机物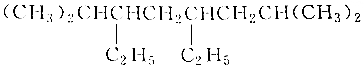 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 | |
| C. | C4H8的同分异构体只有3种 | |
| D. | 液化石油气的主要成分是烃,它是一种清洁燃料 |
分析 A.苯的同系物中必须只含有1个苯环;
B.主链选取除去,不满足侧链最简原则;
C.C4H8可能为烯烃或环烷烃,其同分异构体不止3种;
D.液化石油气的主要成分是乙烯、乙烷、丙烷、丙烯、丁烷、丁烯等.
解答 解:A.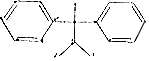 中含有2个苯环,与苯的结构不相似,则该有机物不属于苯的同系物,故A错误;
中含有2个苯环,与苯的结构不相似,则该有机物不属于苯的同系物,故A错误;
B.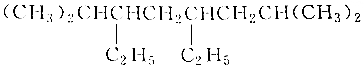 的主链为辛烷,编号从左边开始,在2、7号含有2个甲基,在3、5号碳含有2个乙基,该有机物正确名称为:2,7-二甲基-3,7-二乙基辛烷,故B错误;
的主链为辛烷,编号从左边开始,在2、7号含有2个甲基,在3、5号碳含有2个乙基,该有机物正确名称为:2,7-二甲基-3,7-二乙基辛烷,故B错误;
C.C4H8可能为烯烃,含有3种同分异构体,也可能为环丁烷或甲基丙烷,所以其同分异构体有5种,故C错误;
D.液化石油气的主要成分是烃,燃烧产物为二氧化碳和水,属于清洁燃料,故D正确;
故选D.
点评 本题考查同系物、同分异构体、有机物命名等知识,明确常见有机物命名原则为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
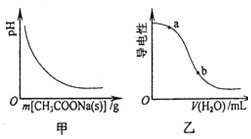
| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 0.10 mol•L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变条件前后,B的转化率均为40% | |
| B. | 改变条件前后,C的反应速率保持不变 | |
| C. | 若保持温度和体积不变,在容器中再充入1molA和1molB,B的转化率不变 | |
| D. | 若保持温度和体积不变,在容器中再充入0.5molB、1molC和1molD,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
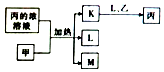 短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y | B. | 元素的非全属性:Z>Y>X | ||
| C. | 化合物XYZ中只含共价键 | D. | K、L、M中沸点最高的是M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
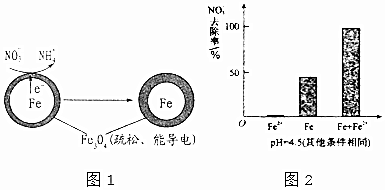
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 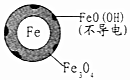 | 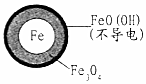 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,9.2gNO2气体中.分子数为0.2NA | |
| B. | pH=2的硫酸溶液中,H+数目为0.01NA | |
| C. | 将0.05molFeCl3全部转化为Fe(OH)3胶体,则胶粒数目为0.05NA | |
| D. | 20gD2O中含有的质子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com