
分析 (1)根据n=cV计算KAl(SO4)2的物质的量,在溶液中完全电离,则n(SO42-)=2n[KAl(SO4)2],c(Al3+)=c[KAl(SO4)2];
(2)明矾物质的量与硫酸铝钾的物质的量相等,根据m=nM计算明矾的质量.
解答 解:(1)KAl(SO4)2的物质的量为0.25L×0.2mol/L=0.05mol,在溶液中完全电离,则n(SO42-)=2n[KAl(SO4)2]=0.05mol×2=0.1mol,c(Al3+)=c[KAl(SO4)2]=0.2mol/L,
故答案为:0.05mol;0.1;0.2;
(2)明矾物质的量与硫酸铝钾的物质的量相等,则明矾的质量为0.05mol×474g/mol=23.7g,
故答案为:23.7.
点评 本题考查物质的量浓度有关计算,比较基础,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若产物中$\frac{n(NaClO)}{n(NaCl)}$=1,则在较低温度下反应,消耗22.4L氧气 | |
| B. | 若产物中$\frac{n(NaClO)}{n(NaCl{O}_{3})}$=1,则在较高温度下反应且生成1.5mol氯化钠 | |
| C. | 改变温度,理论上生成的氯酸钠的物质的量最多为0.5mol | |
| D. | 理论上,上述反应中转移电子最多为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
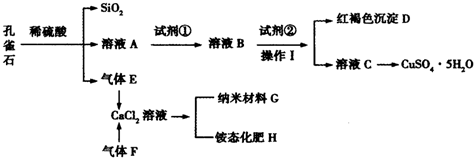
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com