
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
分析 A.铁离子与铜反应生成亚铁离子和铜离子;
B.四氧化三铁与氢离子反应生成铁离子、亚铁离子和水;
C.氧化铝与氢氧化钠反应生成偏铝酸钠和水;
D.铁与稀硫酸反应生成硫酸亚铁和氢气.
解答 解:A.用FeCl3溶液腐蚀铜线路板,反应生成铜离子和亚铁离子,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故A正确;
B.将磁性氧化铁溶于盐酸,反应生成氯化亚铁、氯化铁和水,正确的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O,故B错误;
C.用氢氧化钠溶液除去铝表面的氧化膜,反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故C正确;
D.将铁粉加入稀硫酸中,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故D错误;
故选AC.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
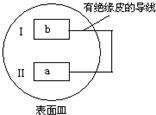 把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )| A. | a是原电池的负极 | B. | b的活泼性大于a | ||
| C. | 无电流产生 | D. | b 电极上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
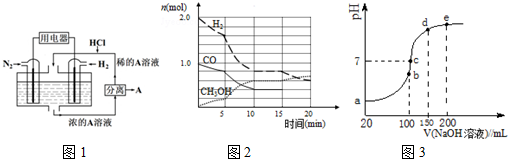
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气是具有热值高、无污染等优点的燃料 | |
| B. | “可燃冰”是将水变为油的新型燃料 | |
| C. | 乙醇是比汽油更环保、不可再生的燃料 | |
| D. | 石油和煤是工厂经常使用的可再生的化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36L | B. | 1.12L | C. | 2.24L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3溶液中,$\frac{1}{2}$c(K+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 某浓度的NaAc溶液的pH=8,则该溶液中的c(Na+)-c(Ac-)=9.9×10-7mol/L | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4两种溶液,c(NH4+)大小顺序为:①>② | |
| D. | 10mLpH=12的烧碱溶液中加入pH=2的酸HA至中性,所需酸溶液的体积V≥10mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com