
【题目】空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
(1)上述3种气体直接排入空气后会引起酸雨的气体有(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 该反应的平衡常数K的表达式为;
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式 , 当标况下有4.48L被处理时,通过电极B的电子数为 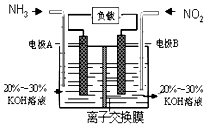
【答案】
(1)SO2、NO2
(2)K= ![]()
(3)2NH3+6e﹣+6OH﹣=N2↑+6H2O;0.8NA
【解析】解:(1)SO2、NO2和CO中,能和空气中的水蒸气反应的有SO2、NO2 , SO2+H2O=H2SO3 H2SO3进一步被氧气氧化为硫酸,3NO2+H2O=2HNO3+NO,硫酸和硝酸融入雨水,形成酸雨,在空气中CO不能与水反应,故答案为:SO2、NO2;(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积,所以ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 平衡常数为:K= ![]() ,故答案为:K=
,故答案为:K= ![]() ;(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,所以电极A极反应式为2NH3﹣6e﹣+6OH﹣═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4﹣0]=0.8mol,故答案为:2NH3+6e﹣+6OH﹣=N2↑+6H2O; 0.8NA .
;(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,所以电极A极反应式为2NH3﹣6e﹣+6OH﹣═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4﹣0]=0.8mol,故答案为:2NH3+6e﹣+6OH﹣=N2↑+6H2O; 0.8NA .
(1)从空气污染的角度分析,利用酸雨形成的过程相关知识解决;(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积;(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,正极反应式为2NO2+8e﹣+4H2O=80H﹣+N2 , 由此分析解答.


科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体, 溶液的pH(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度(填“增 大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和2H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 , 平衡常数表达式为;若有1mol硝酸铵完全分解,转移的电子数为mol。
(3)由N2O、H2O反应生成N2和NO2的能量变化如图所示,若生成1molN2 , 其△H= kJ/mol。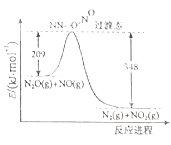
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:K+、Na+、Clˉ、CO32﹣、SO42﹣等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是( ) 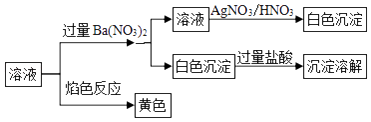
A.该混合物一定是K2CO3和NaCl
B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3
D.该混合物一定是Na2CO3和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶: 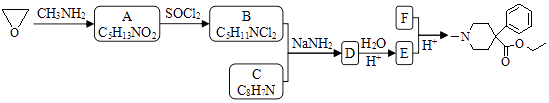
已知RX ![]() RCN
RCN ![]() RCOOH
RCOOH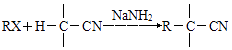
请回答:
(1)A→B的反应类型是 .
(2)下列说法不正确的是 .
A.化合物A的官能团是硝基
B.化合物B可发生消去反应
C.化合物E能发生加成反应
D.哌替啶的分子式是C15H21NO2
(3)写出B+C→D的化学反应方程式 .
(4)设计以甲苯为原料制备C的合成路线(用流程图表示,无机试剂任选) .
(5)写出同时符合下列条件的C的所有同分异构体的结构简式 . ①分子中有苯环而且是苯环的邻位二取代物;
②1H﹣NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生. 
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
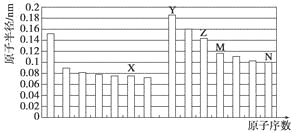
A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的沸点相比,前者较低
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物是空气天然的“净化器”,研究发现,1亩柳杉每天可以吸收5mol SO2 . 则1亩柳杉每天吸收的SO2的质量为( )
A.320g
B.160g
C.64g
D.32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
请按要求回答下列问题。
(1)元素⑧对应的简单离子的结构示意图是____________。
(2)以上元素中,化学性质最不活泼的是 ____________(填元素符号)。
(3)写出元素⑤形成的单质在空气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”或“放热”)反应。
(4)用电子式表示④与⑤形成的A2B型化合物的形成过程___________________________。
(5)在这些元素的最高价氧化物对应水化物中,酸性最强的化合物的分子式是:__________,与元素⑥的最高价氧化物对应水化物发生反应时的离子方程式为________________
(6)③的简单氢化物与③的最高价氧化物对应的水化物反应的生成物中含有的的化学键有____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com