
分析 (1)依据配制一定物质的量浓度溶液的一般步骤排序;
(2)依据配制溶液体积选择合适的容量瓶,依据m=CVM计算需要溶质氯化钠的质量;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=n/V进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:①②④③⑤;
故答案为:①②④③⑤;
(2)需要480mL 0.4mol/L的NaCl溶液,应选择500mL容量瓶;配制500mL0.4mol/L的NaCl溶液,需要溶质的质量m=0.4mol/L×0.5L×58.5g/mol=11.7g,故答案为:500mL;11.7;
(3)①称量时间过长,氢氧化钠吸收空气中的水,实际称得的固体质量偏小,溶质的物质的量偏小,溶液浓度偏低,故选B;
②容量瓶中有少量蒸馏水,在定容过程中也得加蒸馏水,故无影响,故选C;
③溶解NaOH得到的溶液未冷却至室温就转移到容量瓶中,根据热胀冷缩的原理,体积缩小,溶液浓度偏高,故选A;
④定容时俯刻度线,水加少了,浓度偏高,故选A;
⑤加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出,造成浓度偏低,故选B.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格的选择及误差分析方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存 | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- | |
| C. | 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s) | |
| D. | 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-═BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH | |
| B. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| C. | 用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂 | |
| D. | 在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
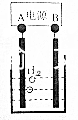 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
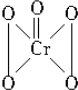
| A. | 全部-1价 | B. | $\frac{4}{5}$为-1价,$\frac{1}{5}$为-2价 | ||
| C. | 全部-2价 | D. | $\frac{4}{5}$为-2价,$\frac{1}{5}$为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
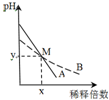 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)>10 c(B) | |
| B. | 中和等浓度等体积的盐酸时,B用的体积较多 | |
| C. | M点时A和B的浓度相等 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者产生等量的氢气 | B. | 强酸溶液产生氢气的速度快 | ||
| C. | 弱酸溶液产生较多的氢气 | D. | 无法比较两者产生氢气的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的△S>0 | |
| B. | 该反应的△H<0 | |
| C. | 该反应的逆反应在一定条件下也能自发进行 | |
| D. | 该反应的熵变效应大于焓变效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com