
| A. | 1.5 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
分析 当碳酸钠滴入盐酸中时发生的反应为:CO32-+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,发生反应为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,根据二者之间的关系式来分析解答.
解答 解:当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为:CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则必须满足:n(HCl)>n(Na2CO3),又由于最终生成的气体体积不同,则HCO3-+H+=H2O+CO2不能全部完成,则应该满足:n(HCl)<2n(Na2CO3),
碳酸钠的物质的量为:0.2mol/L×0.12L=0.024mol,则0.024mol<n(HCl)<0.048mol,
盐酸溶液的体积为:200mL=0.2L,则盐酸的浓度范围为:$\frac{0.024mol}{0.2L}$<c(HCl)<$\frac{0.048mol}{0.2L}$,
即:0.12mol/L<c(HCl)<0.24mol/L,只有C满足该条件,
故选C.
点评 本题考查化学方程式、混合物反应的计算,题目难度中等,明确二者滴定顺序不同其反应方程式不同是解本题关键,再根据题意结合反应方程式进行计算,试题培养了学生的分析能力及化学计算能力.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝不易发生化学反应 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧气氧化 | |
| D. | 铝表面致密的氧化膜能阻止铝进一步被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
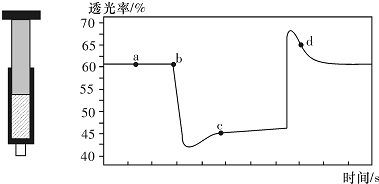
| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染 | |
| B. | 可用丁达尔效应区别胶体和溶液 | |
| C. | 绿色化学的核心是对环境产生的污染进行治理 | |
| D. | PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
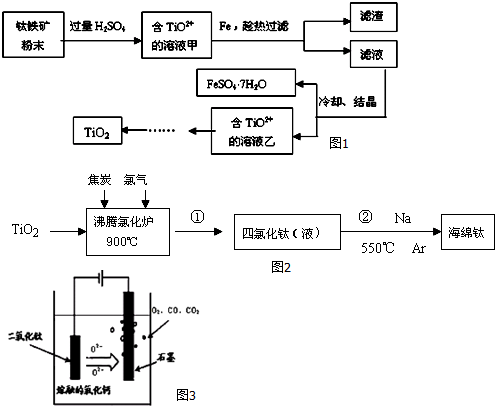
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaC03是难溶于水的强电解质,在医学上用作钡餐 | |
| B. | 常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝 | |
| C. | 明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关 | |
| D. | 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,P元素属于ds区元素.
,P元素属于ds区元素.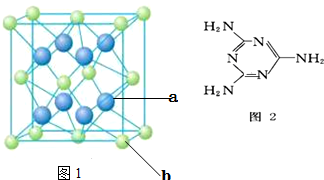
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
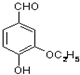 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
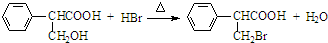 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.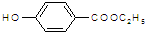 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用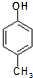 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).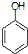 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$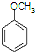 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$
 $→_{催化剂}^{H_{2}△}$
$→_{催化剂}^{H_{2}△}$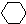 $→_{光照}^{Br_{2}}$
$→_{光照}^{Br_{2}}$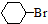
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com