
| A. | 氯乙烷与氢氧化钠醇溶液共热:C2H5Cl+OH-$\stackrel{△}{→}$C2H5OH+Cl- | |
| B. | 溴乙酸与热氢氧化钠溶液反应:BrCH2COOH+OH-=BrCH2COO-+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 乙醛与氢氧化铜碱性悬浊液共热: CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
分析 A.氯乙烷与氢氧化钠醇溶液共热发生消去反应生成乙烯和NaCl;
B.溴乙酸和NaOH的水溶液发生取代反应、中和反应;
C.二者反应生成苯酚和碳酸氢钠;
D.二者发生氧化还原反应生成乙酸钠、氧化亚铜和水.
解答 解:A.氯乙烷与氢氧化钠醇溶液共热发生消去反应生成乙烯和NaCl,离子方程式为C2H5Cl+OH-$\stackrel{△}{→}$C2H4+Cl-+H2O,故A错误;
B.溴乙酸和NaOH的水溶液发生取代反应、中和反应,离子方程式为BrCH2COOH+2OH-=HOCH2COO-+Br-+H2O,故B错误;
C.二者反应生成苯酚和碳酸氢钠,离子方程式为C6H5O-+H2O+CO2→C6H5OH+HCO3-,故C错误;
D.二者发生氧化还原反应生成乙酸钠、氧化亚铜和水,离子方程式为CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,明确离子方程式书写规则、物质性质是解本题关键,有些离子方程式还与反应物的量、反应物浓度、反应条件等有关,易错选项是C,无论二氧化碳是否过量都生成碳酸氢钠.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na202比Na2O稳定,保存时可直接露置于空气中 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| D. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
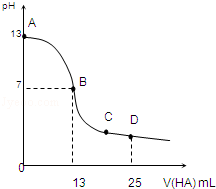 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 碱性氧化物 | 碱 | 含氧酸 | 盐 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
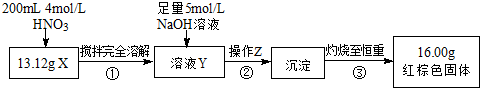
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质粒子能通过滤纸,而其他分散系的分散质粒子不能通过滤纸 | |
| B. | 氢氧化铁胶体、硫酸铜溶液用激光笔照射,均能观察到一条光亮的通道 | |
| C. | 胶体区分于溶液的本质特征是胶体的分散质粒子直径在1nm~100nm之间 | |
| D. | 氢氧化铝和氢氧化铁胶体可用于净水是因为它们具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2均是非电解质,所以NH3、CO2的水溶液均不能导电 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com