
| A. | 推广利用太阳能、风能的城市照明系统,发展低碳经济和循环经济,有利于改善环境质量 | |
| B. | 油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 | |
| C. | 处理废水时可加入明矾作为混凝剂,以吸附水中的杂质 | |
| D. | 硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物 |
分析 A.减少含C化合物的使用,实现低碳排放;
B.油脂在碱性条件下的水解为皂化反应;
C.明矾中铝离子水解生成胶体,具有吸附性;
D.根据含有元素的种类判断,光导纤维的主要原料是二氧化硅,二氧化硅中不存在分子.
解答 解:A.发展低碳经济,循环经济,推广利用太阳能的城市照明系统,节电降低发电用的能耗,符合低碳环保理念,有利于改善环境质量,故A正确;
B.油脂在碱性条件下水解生成高级脂肪酸钠,可用于制造肥皂,故B正确;
C.明矾水解可生成具有吸附性氢氧化铝胶体,可除去水中的悬浮物,故C正确;
D.硬铝是铝、铜、镁、硅的合金,碳素钢含有碳和铁,所以都是合金材料,光导纤维的主要原料是二氧化硅,二氧化硅是原子晶体,不含分子,所以光导纤维不是有机高分子化合物,故D错误.
故选D.
点评 本题考查生活中的化学知识,掌握低碳经济、肥皂制取原理、常见的混凝剂、光导纤维的主要原料等知识是解答的关键,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 离子是带电荷的粒子 | 带电荷的粒子一定是离子 |
| B | 稀硫酸作电解质溶液时,氢氧燃料电池的负极反应为 2H2-4e-=4H+ | 氢氧化钾溶液作电解质溶液时,氢氧燃料电池的负极反应为2H2-3e-+4OH-=4H2O |
| C | 将Fe加入到CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| D | 原电池中通常是活泼金属做负极,不活泼金属做正极 | 铜和铝与浓硝酸构成原电池时,铜是正极 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
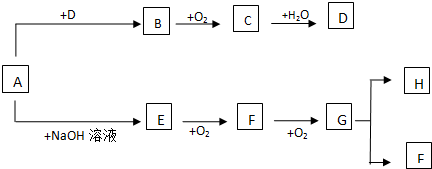
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
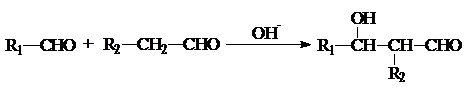 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下: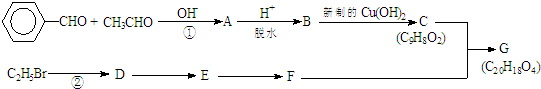
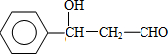 ,F 的结构简式是CH2OHCH2OH;
,F 的结构简式是CH2OHCH2OH; +CH2OHCH2OH$→_{△}^{浓硫酸}$
+CH2OHCH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
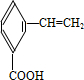 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量:| 化学键 | H-H | Cl-Cl | I-I | O═O | C-Cl | C-H | O-H | H-Cl | H-I |
| 断裂1mol化学键所吸收的能量(kJ) | 436 | 247 | 151 | x | 330 | 413 | 463 | 431 | 299 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
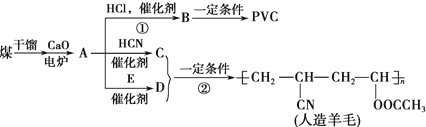
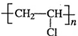 ,CH2C=HC-CN.
,CH2C=HC-CN.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a中试剂 | b中试剂 | 实验现象 | 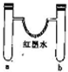 |
| A | 1mL12mol•L-1浓盐酸0.5gMnO2 | 0.1gCaCO3、1mL 2mol•L-1盐酸 | 红墨水褪色,U形管中液面左右基本持平 | |
| B | 0.1gNa3mol水 | 0.1gNa 3mol乙醇 | 反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高 | |
| C | 3mL浓硫酸、铁钉 | 3mLNaCl溶液、铁钉 | 铁钉均生锈,U形管中液面左高右低 | |
| D | 3mL水 | 3mL饱和FeSO4溶液 | 一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com