
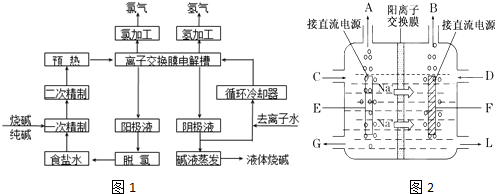
分析 (1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠.
解答 解:(1)根据工艺流程图结中用到的原料以及产物,可以知道从阳极槽出来的淡盐水中含有氯化钠可以循环使用,电解产生的氢氧化钠可作为在进入电解槽前需要进行两次精制的原料,也是可以循环使用的物质,
故答案为:氯化钠、氢氧化钠(或NaCl、NaOH);
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,若食盐水不经过二次精制,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,少量Mg2+、Ca2+在电解碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的总方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:H2;阳极;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl,故答案为:Na2SO3+Cl2+H2O=Na2SO4+2HCl.
点评 本题以氯碱工业为载体,考查学生生化学工艺流程题的解题方法知识,注意电解池的工作原理的灵活应用是关键,题目难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
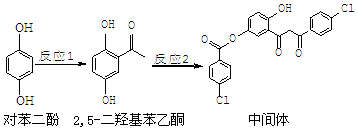
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有羰基和烃基两种含氧官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L C2H4与C3H6混合气体所含有分子数为NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1mol Na2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18g NH4+所含的电子数11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室效应的排放 | |
| B. | 胶体和溶液的本质区别是胶体具有丁达尔现象 | |
| C. | SiO2既能与氢氧化钠溶液反应又能与氢氟酸反应,SiO2是两性氧化物 | |
| D. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 和 CO | B. | CO2 和 N2O | C. | O3 和 CO2 | D. | CO32- 和 NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | 使pH试纸显蓝色的溶液:Cu2+、NO3-、Fe3+、SO42- | |
| C. | 与铝粉反应放出H2的无色溶液:NO3-、Al3+、Na+、SO42- | |
| D. | 常温下$\frac{c({H}^{-})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | Cl2中有少量的HCl:通过氢氧化钠溶液洗气 | |
| D. | CO2中混有少量的SO2气体:通过饱和NaHSO3溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 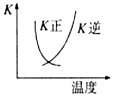 2SO2(g)+O2(g)?2SO3(g)△H<0的正、逆反应的平衡常数K随温度的变化可用图表示 | |
| C. | 2NO+2CO?2CO2+N2 △H<0,常温下该反应一定能自发进行 | |
| D. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com