
在短周期主族元素中:
(1)由两种元素组成的化合物种类最多,其中最简单化合物的电子式为 。
(2)元素D的氢化物与D的最高价氧化物对应水化物化合得到的物质是(填化学式)__________;D的氢化物的水溶液常温下pH_____7(填“>”、“<”、“=”);D的最高价氧化物对应水化物的浓溶液与试管中足量铜片反应,开始产生有色气体,一段时间后则产生无色气体,写出产生无色气体的离子方程
式 。
(3)元素R与元素E的原子序数之比为2∶1,其单质直接反应后得到的化合物中元素质量比为1∶1,该化合物的化学式为________;该化合物_______(填“能”或“不能”)使品红溶液褪色。若含2 mol R元素的最高价氧化物对应水化物的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定: 22.4 L(填“大于”,“小于”或“等于”)。
(1)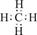 ;
;
(2)NH4NO3;>;8H++2NO3-+3Cu = 3Cu2++2NO↑+4H2O; (3)SO2 ;能;小于
解析试题分析:在短周期主族元素中:
(1)由两种元素组成的化合物种类最多,由于化合物种类最多的是有机化合物,则一种元素一定是碳元素。由于是由两种元素组成的,所以该类化合物是烃类,其中最简单化合物是甲烷,含有4个C-H键,其电子式为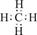 。
。
(2)元素D的氢化物与D的最高价氧化物对应水化物化合能反应,这说明元素D应该是N元素,则氨气与硝酸反应生成的物质是NH4NO3;氨气溶于水生成一水合氨,电离出OH-,溶液显碱性,所以溶液的pH>7;D的最高价氧化物对应水化物的浓溶液是浓硝酸,具有强氧化性,与铜发生氧化还原反应生成硝酸铜、NO2和水。随着反应的进行,浓硝酸的浓度降低,由此反应后期产生无色的NO气体,此时反应的离子方程式为8H++2NO3-+3Cu = 3Cu2++2NO↑+4H2O。
(3)元素R与元素E的原子序数之比为2∶1,其单质直接反应后得到的化合物中元素质量比为1∶1,则在短周期元素中符合条件的是S和O,则二者化合生成的化合物是SO2。SO2具有漂白性,能使品红溶液褪色。S的最高价氧化物对应水化物是硫酸,浓硫酸具有强氧化性,在加热的条件下与铜反应生成硫酸铜、SO2与水,反应的化学方程式为2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑。但由于随着反应的进行,浓硫酸的浓度变小,稀硫酸与铜不反应,所以含2 mol R元素的最高价氧化物对应水化物的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定小于22.4L。
CuSO4+2H2O+SO2↑。但由于随着反应的进行,浓硫酸的浓度变小,稀硫酸与铜不反应,所以含2 mol R元素的最高价氧化物对应水化物的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定小于22.4L。
考点:考查甲烷结构;氨气、硝酸的性质;SO2和硫酸的性质以及氧化还原反应的计算


科目:高中化学 来源: 题型:填空题
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热
条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是 。
(2)组成单质B的元素的原子结构示意图为 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为 。
(4)溶液F在空气中长期放置生成H的化学方程式为 。
(5)H的溶液与稀硫酸反应产生的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0 ℃ | 57.6 ℃ | -84.7 ℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为_________。该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是_______。
(2)除去FeCl2溶液中少量的FeCl3最好加入_________物质。
(3)鉴别Na2CO3和NaHCO3溶液可选用_________。(填序号)
①NaOH;②Ca(OH)2;③BaCl2;④K2SO4;⑤Ca(NO3)2
(4)某溶液中有①SO42―②Mg2+③Fe2+④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
(5)将盛有18mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
①1.2mL②2.4mL③3.6mL④5.2mL
| A.①② | B.①③ | C.②④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系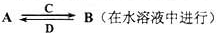
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式 ;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 . A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素。请回答下列问题:
(1)①B在元素周期表中的位置________________________________;
②上述元素的最高价氧化物的水化物中酸性最强的是_______________(写化学式)。
(2)C、D、E、F四种元素对应的简单离子的半径由小到大的顺序是______________________________。(用离子符号表示)。
(3)A、C、D、E中的三种或四种元素形成的多种离子化合物中,溶液呈酸性的有____________(写化学式,任写一种即可);上述离子化合物中还有可以和盐酸发生氧化还原反应的,该反应的离子方程式为________________________________________。
(4)工业上常用A、B组成的物质X来检验F的单质是否发生泄漏,有大量白烟生成,写出此反应的化学反应方程式________________________________。其中该反应中还原剂和氧化剂的物质的量之比为__________________。
(5)A和C可形成两种液态化合物Y和Z,用电子式表示原子个数之比1︰1的物质Y的形成过程_____________________;在微电子工业中,X的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为_________________。
(6)某BC和BC2的混合气体,且n(BC)︰n(BC2)=1︰3,现向混合气体中补充一定量的氧气,再一起通入石灰乳中,BC和BC2恰好被吸收,生成B的最高价含氧酸盐,从而可以除去BC和BC2的混合气体。写出此吸收法除去该混合气体的总化学反应方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X2、Y2单质在一定条件下有如下反应:X2+Y2+H2O→HXO3+HY(未配平)。
按要求回答下列问题:
(1)X2、Y2可能的组合是__________________。
a.F2、Br2 b.I2、Cl2 c.C12、O2 d.Br2、N2
(2)试比较X2、Y2、HXO3的氧化性强弱:___________________[用(1)中所选的X2、Y2回答,下同]。判断HXO3+HX能否反应:___________(填“能”或“不能”)。若能反应,请写出其化学反应方程式,若不能反应,请说明理由:____________________。
(3)若用KX制取HX,不能选用浓硫酸的原因是________________________。(用化学方程式表示)
(4)工业上测定某产品中YO-的含量,先将一定量产品的溶液加入过量的KX溶液和稀硫酸中,使之反应生成X2,试写出上述反应的离子方程式:______________________。
(5)Fe2+、Fe3+、X2、X-、Y-五种微粒中的两种微粒A(阳离子)和B在溶液中能相互反应生成X2,向含微粒A的溶液中滴入足量l mol/LNa2S溶液,生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D再与稀硫酸完全反应生成E溶液。则生成的沉淀C的成份是(填化学式)____________________。E溶液中阳离子除H+外,另外的阳离子的检验方法是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。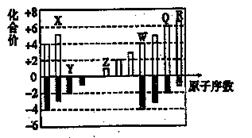
(1)元素Q位于周期表中第 周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是 。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为 。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com