
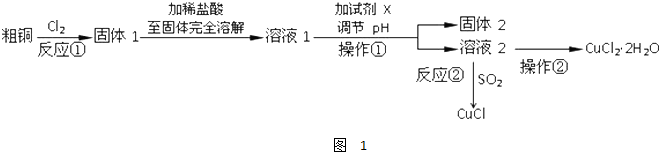

分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体2为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl2•2H2O.
(1)操作①为过滤,过滤操作需要玻璃仪器为:漏斗、玻璃棒、烧杯;
(2)氯化铜、氯化铁中的金属离子易水解,加入过量的酸可以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子;
(3)铜离子是氧化剂,SO2是还原剂,反应生成CuCl白色沉淀和SO42-;
(4)①KMnO4与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气;应先制备氯气,通一段时间排出装置中空气,防止铜被氧气氧化;
②Cu与Cl2反应产生大量棕黄色烟(CuCl2);
(5)根据平衡移动原理分析.
解答 解:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)铁离子转化为氢氧化铁沉淀,过滤得到的固体2为氢氧化铁,所以操作①为过滤,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯,所以用到的玻璃仪器有漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒、烧杯;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,硫酸铜与氢离子不反应,不选,故用CuO或Cu2(OH)或Cu2(OH)2CO3,
故答案为:抑制氯化铜、氯化铁水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(4)①仪器连接顺序:Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置,KMnO4与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气,所以按气流方向各仪器接口顺序是:a→d、e→h、i→f、g→b,应先制备氯气,通入一段时间的氯气,排出装置中空气,防止铜被氧气氧化,
故答案为:d、e、h、i、f、g、b;通入一段时间的氯气,将装置中的空气排尽;
②Cu与Cl2反应产生大量棕黄色烟(CuCl2),则反应时盛粗铜粉的试管中的现象是产生大量棕黄色烟;
故答案为:产生大量棕黄色烟;
(5)a.将Y稀释,平衡向作反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故选:abc.
点评 本题考查实验制备方案,涉及对装置的分析评价、物质的分离提纯、对操作的分析评价、含量测定等,注意对题目信息的提取应用,侧重考查学生分析解决问题的能力、知识迁移运用能力,题目难度较大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑤⑦ | C. | ②③⑥⑦ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
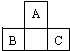 短周期元素A、B、C在元素周期表中的位置如图所示,已知B、C两元素的原子序数之和是A元素原子序数的4倍,A、B、C三元素应分别为( )
短周期元素A、B、C在元素周期表中的位置如图所示,已知B、C两元素的原子序数之和是A元素原子序数的4倍,A、B、C三元素应分别为( )| A. | C、Al、P | B. | O、P、Cl | C. | N、Si、S | D. | F、S、Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
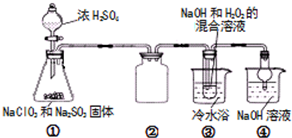 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-Q1kJ/mol CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H=-Q2kJ/mol | |
| B. | S(s)+O2(g)═SO2(g)△H=-Q1kJ/mol S(g)+O2(g)═SO2(g)△H=-Q2kJ/mol | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol | |
| D. | HCl(aq)+NaOH(aq)═+NaCl(aq)+H2O(I)△H=-Q1kJ/mol CH3COOH(aq)+NaOH(aq)═CH3COOHNa(aq)+H2O(l)△H=-Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
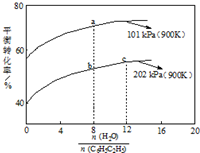 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )| A. | a、b两点转化率不等,但是化学平衡常数相等 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{3}$ | |
| C. | 恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 | |
| D. | b点和c点温度和压强相同,故其反应速率也相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com