
【题目】将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是( )
选项 | 实验现象 | 结论 |
A | 方形金属钠变成小球 | 钠与水的反应吸热 |
B | 钠浮于水面游动 | 水的密度大于钠的 |
C | 酚酞溶液变成红色 | 有碱性物质生成 |
D | 钠球游动有吱吱声 | 有气体生成 |
A. A B. B C. C D. D
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海洋植物中提取碘的流程如下: ![]()
某化学兴趣小组将上述流程②③设计成如图所示实验.
已知:②中发生反应的化学方程式为Cl2+2KI═2KCl+I2 .
(1)写出提取流程中①③实验操作的名称:① , ③ .
(2)四氯化碳是无色、密度比水大的液体.F中下层液体的颜色为色,上层液体中溶质的主要成分为 .
(3)从F中得到碘单质还需进行的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内所用仪器补充填写完整 ①用20mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复至室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀.
(3)实验中上述步骤的正确顺序为(填序号).
(4)填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”). ①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
(5)取用任意体积的所配0.5mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量
B.溶液的浓度
C.溶液中SO42﹣的数目
D.溶液的密度
(6)在容量瓶上,下列标记不存在的是(填字母)
A.标线
B.温度
C.浓度
D.容量规格.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将44.8LHCl气体溶于1L水中,所得盐酸溶液的密度为1.1g/cm3,该盐酸的物质的量浓度为
A. 2mol/L B. 2.1mol/L C. 2.2mol/L D. 2.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+ ),所需S2-最低浓度的对数值lgc(S2-)与lg(M2+)的关系如图所示。下列说法正确的是
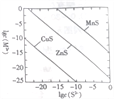
A. 三种离子对应的硫化物中Ksp(CuS)最小,约为1×10-20
B. 可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2
C. 向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大
D. 向浓度均为1×10-5 mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入l×l0-4 mol·L-1的Na2S溶液,Zn2+最先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-2.92 kJ·mol-1
B. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-18 kJ·mol-1
C. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-73 kJ·mol-1
D. Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是 ( )
A. 都是含极性键的共价化合物 B. 都是含非极性键的离子化合物
C. 互为同分异构体 D. 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
还到平衡的时间/min | 5 | 8 | |
A的浓度/mol L-1 | cl | c2 | O |
C的体积分数/% | ω1 | ω3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是
A. 若x<4,则2c1<c2
B. 若x=4,则ω1=ω3
C. 无论x的值是多少,均有2ρ1=ρ2内
D. 容器甲中反应从开始到平衡的平均反应速率可能为v(A)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:
c(Na+)=c(SO4-)>c(NH4+)>c(H+)>c(OH-)
B. 25℃时,0.1mol L-1的HA溶液中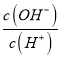 = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com