
 A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质.
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、0.1mol过氧化钠固体中含阴离子个数为0.2NA |
| B、1mol金刚石中含C-C的数目为4NA |
| C、标准状况下,22.4L乙炔中含π键数为2NA |
| D、1molNaHSO4晶体中阳离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2):v(H2):v(NH3)=1:3:2 |
| B、c(N2):c(H2):c(NH3)=1:3:2 |
| C、容器内混合气体的平均相对分子质量不变 |
| D、单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
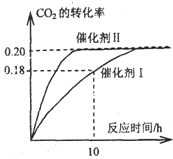 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
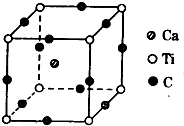 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=2c(S2-) |
| B、c(OH-)=c (H+)+c (HS-)+2c (H2S) |
| C、c(Na+)>c(S2-)>c (HS-)>c (OH-) |
| D、c(Na+)+c (H+)=2c (S2-)+c (HS-)+c (OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com