
【题目】在0.1 molL1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO- + H+,对于该平衡,下列叙述正确的是
CH3COO- + H+,对于该平衡,下列叙述正确的是
A. 加热,平衡向逆反应方向移动
B. 加入少量0.05 molL﹣1 H2SO4溶液,溶液中c(H+)不变
C. 加入少量NaOH固体,平衡向正反应方向移动
D. 加入少量水,水的电离平衡不移动
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素为周期表前20号元素且原子序数依次增大,其中只有A、D为非金属元素。A的气态氢化物溶于水得到的溶液能使酚酞溶液变红。B、C、D的最高价氧化物对应水化物相互之间能够两两反应,且D原子最外层电子数是C原子最外层电子数的2倍。B、E元素同主族。
(1)E在元素周期表中的位置:____________,写出E的最高价氧化物对应水化物与C的单质反应的化学方程式:___________________________________。
(2)A的气态氢化物溶于水后的电离方程式为________________________________。
(3)B单质在空气中燃烧后的产物的电子式为____________,产物中存在的化学键类型有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
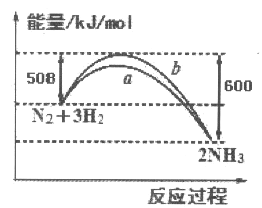
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法正确的是
A. 1 mol Z最多能与2 mol NaOH反应
B. Y可以发生取代反应、氧化反应、消去反应
C. 可用FeCl3溶液鉴别Y和Z
D. X分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是

A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 在0≤pH≤5时,HMnO4溶液满足![]()
C. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:

(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为1×10﹣3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)氨水的电离方程式为_______,硫酸铵在水溶液中水解的离子方程式为___________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________________________。
(3)在某温度下(Kw=1×10﹣12),将100 mL的①与100 mL的⑥溶液混合后(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的pH=_________。
(4)若将等体积的②、③溶液加热至相同温度后,溶液的pH ②_______③(填“>” 、“=”或“<”)。
(5)室温时,若用①滴定⑤,适宜的指示剂为_____,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是

A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com