
请将下列物质的序号按要求填空:①石墨②铁钉③氧化钠④二氧化硫⑤水⑥盐酸⑦硫酸⑧氢氧化钙⑨氟化钠⑩甲烷,其中属于电解质的是 ,属于非电解质的是 ,属于强电解质的是 ,属于弱电解质的是 .写出③的电子式: ,⑩的结构式 ,⑨的水溶液显 (填“酸性”、“碱性”、“中性”),用离子方程式解释 .
考点:
电解质与非电解质;酸、碱、盐、氧化物的概念及其相互联系;电子式、化学式或化学符号及名称的综合;强电解质和弱电解质的概念.
专题:
物质的分类专题.
分析:
电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物;
强电解质是指在水溶液中,或熔融状态下能完全电离的化合物;弱电解质是指在水溶液中或熔融状态下能部分电离的化合物;
单质,混合物既不是电解质也不是非电解质;氧化钠由钠离子和氧根离子构成;甲烷分子中只存在碳氢键;氟化钠为强碱弱酸盐.
解答:
解:①石墨是单质,故既不是电解质,也不是非电解质;
②铁钉主要成分是铁,是铁的合金,故既不是电解质,也不是非电解质;
③氧化钠是由钠离子和氧离子构成,电子式为: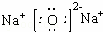 ,它在水溶液中,或熔融状态下能完全电离的化合物,是强电解质;
,它在水溶液中,或熔融状态下能完全电离的化合物,是强电解质;
④SO2常温下为气体,只有SO2分子,没有自由移动的离子,虽SO2在水溶液中与水反应,生成亚硫酸,亚硫酸电离出自由移动的离子,溶液能够导电,但自由移动的离子不是SO2自身电离.SO2是化合物,故SO2是非电解质;
⑤水只能部分电离出氢离子和氢氧根离子,是弱电解质;
⑥盐酸是氯化氢的水溶液,是混合物,不是化合物,所以不是电解质;
⑦硫酸水溶液能导电,为自身完全电离出的自由移动的氢离子和硫酸根离子,所以硫酸是强电解质;
⑧氢氧化钙水溶液或熔融状态下都能导电,均为自身完全电离出的自由移动的钙离子和氢氧根离子,所以氢氧化钙是强电解质;
⑨氟化钠水溶液或熔融状态下都能导电,均为自身完全电离出的自由移动的钠离子和氟根离子,所以氟化钠是强电解质,氟化钠为强碱弱酸盐,电离出的氟离子水解,F﹣+H2O⇌HF+OH﹣,溶液呈碱性;
⑩甲烷是有机化合物,分子中只存在碳氢键,结构式为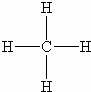 ,它难溶于水,只存在甲烷分子,不导电,属于非电解质,
,它难溶于水,只存在甲烷分子,不导电,属于非电解质,
故答案为:③⑤⑦⑧⑨;④⑩;③⑦⑧⑨;⑤;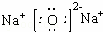 ;
; ;碱性;F﹣+H2O⇌HF+OH﹣.
;碱性;F﹣+H2O⇌HF+OH﹣.
点评:
本题重点考查了电解质、强电解质、盐的水解等知识,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,盐的酸碱性依据盐类水解的规律,进行解题,题目难度不大.


科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
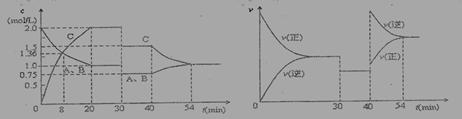
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险.由于人体体液的缓冲系统中存在如下平衡:
H++HCO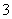
 H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO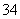
 HPO
HPO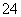
H++HPO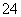
 H2PO
H2PO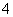
故能维持血液pH的相对稳定,以保证正常生理活动.下列说法中不合理的是 ( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)═2P2O5(s)△H=﹣a kJ/mol(a>0);4P(红磷,s)+5O2(g)═2P2O5(s)△H=﹣b kJ/mol(b>0),则a和b的关系是( )
|
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是( )
|
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 |
|
| C. | 物质B的质量分数增加了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时有pH=12的NaOH溶液100mL,要使它的pH为11.(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L 盐酸,应加 mL;
(4)如果加0.01mol/L 醋酸,所加体积比0.01mol/L 盐酸所用体积 (填“多”、“少”、“一样”)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中的微粒浓度关系正确的是( )
|
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣) |
|
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3) |
|
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
|
| D. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是()
A.  (A﹣N+m)mol B.
(A﹣N+m)mol B. 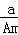 (A﹣N)mol C.
(A﹣N)mol C.  (A﹣N)mol D.
(A﹣N)mol D. 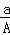 (A﹣N+m)mol
(A﹣N+m)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com