
分析 (1)在空气中充分燃烧生成二氧化碳和水,根据原子守恒配平方程式;
(2)相同状况下,等体积的气态烃,消耗O2的量取决于(x+$\frac{y}{4}$)的值,(x+$\frac{y}{4}$)越大消耗O2的量越多;
(3)等质量的烃,在充分燃烧时,消耗O2的量取决于H的质量分数ω(H),ω(H)越大消耗O2的量越多;
(4)根据完全燃烧消耗O2的量,先判断是否完全燃烧,再根据方程式利用差量法计算.
解答 解:(1)烷烃CnH${\;}_{2n+{2}_{\;}}$(n≥1)在足量的氧气中充分燃烧生成二氧化碳和水,反应的化学方程式为2CnH2n+2+(3n+1)O2$\stackrel{点燃}{→}$2nCO2+(2n+2)H2O.
故答案为:2CnH2n+2+(3n+1)O2$\stackrel{点燃}{→}$2nCO2+(2n+2)H2O;
(2)①甲烷,分子式为CH4②乙烷,分子式为C2H6③丙烷,分子式为C3H8,④丁烷,分子式为C4H10,它们的(x+$\frac{y}{4}$)值分别为2、3.5、5、6.5,丁烷的(x+$\frac{y}{4}$)值最大,即消耗O2的量最多,
故答案为:④;
(3)①甲烷,分子式为CH4②C、H原子个数比为1:4,H的质量分数ω(H)最大,消耗O2的量最多,
故答案为:①;
(4)①甲烷,②乙烷,③丙烷,④丁烷4种烷烃中它们的(x+$\frac{y}{4}$)值分别为2、3.5、5、6.5,10ml完全燃烧需要的氧气的体积分别为20ml、35ml、50ml、65ml,
所以只有丁烷不能完全燃烧,
若完全燃烧,则混合气体是CO2、O2,设烃为CxHy,则
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),体积减小△V
1 1+(x+$\frac{y}{4}$)-x=1+$\frac{y}{4}$
10 (10+50-35)=25
所以10(1+$\frac{y}{4}$)=25,解得y=6,即1分子烃中H的原子个数是6,
氧气有剩余,所以10(x+$\frac{y}{4}$)<50,由于y=6,解得x<3.5,
所以气态烃为乙烷,
若不完全燃烧,10mL丁烷生成CO需要氧气为45ml,小于50ml,所以混合气体是CO2、CO,设烃为CxHy,根据C原子守恒,有10x=35,解得,x=3.5,碳原子数目为整数,不成立.
故答案为:乙烷.
点评 本题是一道有关有机物计算的题目,考查学生分析、解决问题的能力和计算能力,难度中等,熟记结论,使用体积差的计算方法要注意.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变为棕黄色,说明氯水中含有HClO | |
| C. | 向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
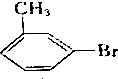 ,写出其同分异构体的结构简式:
,写出其同分异构体的结构简式: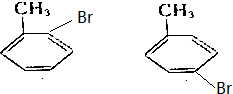 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
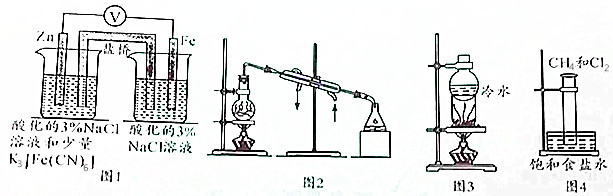
| A. | 用图1所示装置验证牺牲阳极的阴极保护法 | |
| B. | 用图2所示装置可在实验室制备蒸馏水 | |
| C. | 用图3所示装置可以进行NaCl与NH4Cl、NaCl与I2的分离 | |
| D. | 用图4所示装置进行CH4取代反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与HCl加成只生成一种产物 | D. | 能与Cl2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
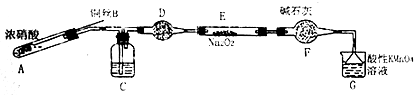
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.7 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com