
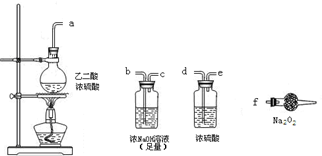
 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为______;若CO能够与Na2O2发生反应,则预测反应产物为______.
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为______;若CO能够与Na2O2发生反应,则预测反应产物为______. O2(g)=CO2(g),△H=-283.0kJ?mol-1,写出CO2 和C(s)反应的热化学方程式______.以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______.若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)______L.
O2(g)=CO2(g),△H=-283.0kJ?mol-1,写出CO2 和C(s)反应的热化学方程式______.以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______.若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)______L. O2(g)=CO2(g),△H=-283.0kJ?mol-1,依据盖斯定律计算,①-②×2得到CO2 和C(s)反应的热化学方程式为:CO2(g)+C(s)=2CO(g)△H=+172.5 kJ?mol-1;以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,依据原电池反应原理可知负极是一氧化碳失电子发生氧化反应生成二氧化碳的过程,根据电解质环境是熔融碳酸盐和电子守恒得到负极电极反应为:CO+CO32-→2CO2+2e-;
O2(g)=CO2(g),△H=-283.0kJ?mol-1,依据盖斯定律计算,①-②×2得到CO2 和C(s)反应的热化学方程式为:CO2(g)+C(s)=2CO(g)△H=+172.5 kJ?mol-1;以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,依据原电池反应原理可知负极是一氧化碳失电子发生氧化反应生成二氧化碳的过程,根据电解质环境是熔融碳酸盐和电子守恒得到负极电极反应为:CO+CO32-→2CO2+2e-;  2NaOH+Cl2↑+H2↑;Cl2+2NaOH=NaClO+NaCl+H2O;得到NaCl+H2O
2NaOH+Cl2↑+H2↑;Cl2+2NaOH=NaClO+NaCl+H2O;得到NaCl+H2O NaClO+H2↑依据电子守恒得到:O2~4e-~2NaClO,则理论上需要氧气物质的量为0.5mol,氧气的体积为(标准状况下) 11.2L;
NaClO+H2↑依据电子守恒得到:O2~4e-~2NaClO,则理论上需要氧气物质的量为0.5mol,氧气的体积为(标准状况下) 11.2L;

 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:阅读理解

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
| ||
| (一定条件) |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com