
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.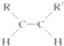 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$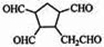 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):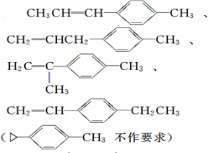 .
. 分析 (1)与双键碳直接相连的原子一定在同一平面内;
(2)根据结构简式判断有机物的分子式和基团数目;
(3)由合成路线可知,反应②为消去反应,反应③为加成反应,反应④为消去反应,以此来解答;
(4)由信息可知,碳碳双键的碳被氧化为醛基;
(5)能使溴的四氯化碳溶液褪色,应含有碳碳双键,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸,说明烃基位于对位位置.
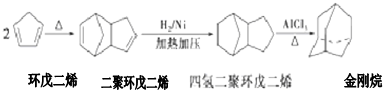
解答 解:(1)C=C为平面结构,与双键碳直接相连的原子一定在同一平面内,则5个C和4个H在同一平面内,
故答案为:9;
(2)由结构简式可知金刚烷的分子式为C10H16,
故答案为:C10H16;
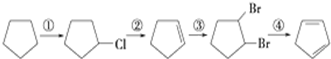
(3)由合成路线可知,反应②为消去反应,反应③为加成反应,反应④为消去反应,
则反应②为卤代烃的消去反应,反应条件为NaOH/醇溶液、加热,反应③类型为加成反应,反应④为 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr,
+2NaBr,
故答案为:NaOH/醇溶液、加热;加成反应; +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.
(4)由信息可知,碳碳双键的碳上含H原子被氧化为醛,则发生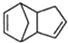 $\stackrel{臭氧}{→}$$\stackrel{水/锌}{→}$
$\stackrel{臭氧}{→}$$\stackrel{水/锌}{→}$ ,
,
故答案为: .
.
(5)能使溴的四氯化碳溶液褪色,应含有碳碳双键,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸,说明烃基位于对位位置,可能的结构有 ,
,
故答案为: .
.
点评 本题考查有机物的合成及结构与性质,注意把握有机物的官能团、碳链骨架等的变化,明确发生的反应及习题中的信息即可解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用排饱和食盐水法收集Cl2 | |
| B. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| C. | 加入催化剂可以提高原料转化率,生成更多产物 | |
| D. | 分别用等体积的蒸馏水和0.01mol/L的硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | HO-CH2-CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气热值高,其燃烧产物是水,是一种理想的清洁燃料 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 石油作为重要的可再生能源应该被尽量地利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/(L•S) | B. | 0.1mol/(L•S) | C. | 0.04mol/(L•S) | D. | 0.08mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com