
在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L﹣1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L﹣1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(2y﹣x) kJ•mol﹣1
B. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(4x﹣y) kJ•mol﹣1
C. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(2x﹣y) kJ•mol﹣1
D. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(8x﹣2y) kJ•mol﹣1
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:选择题
常温下a mol•L﹣1稀氨水和b mol•L﹣1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A.若a=b,则c(NH4+)=c(Cl﹣)
B.若a>b,则c(NH4+)>c(Cl﹣)
C.若a>b,则c(OH﹣)>c(H+)
D.若a<b,则c(OH﹣)<c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期半期考试化学试卷(解析版) 题型:填空题
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题:
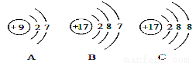
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中必修化学试卷(解析版) 题型:选择题
下列材料属于复合材料的是
A.硬币 B.聚氯乙烯塑料
C.氮化硅陶瓷 D.钢筋混凝土
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:实验题
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
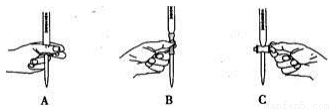
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 | |
体积(mL) | 浓度(mol•L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
(4)写出表中a 对应的实验目的 ;
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1次 | 第2 次 | 第3 次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示) 为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:实验题
(16分)分离和提纯在生产和生活中得以广泛应用,请完成以下两个小题:
ⅰ、我们饮用的水是由原水净化所得。原水中含有泥沙、悬浮物和细菌等杂质。家庭的饮用水可经过如下的净化步骤:
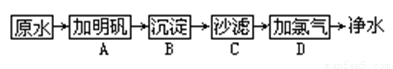
则:(1)可以除去大颗粒悬浮物质的步骤是_____________。
(2)能消毒杀菌的步骤是___________。
ⅱ、下列操作过程中采用了哪些分离或提纯的方法?
①分离食盐与碳酸钙混合物:__________________________________;
②从溴水中提取单质溴(溴的性质与碘的相似):_________________;
③酿酒时提高酒的度数:_____________;④古代制盐;___________________;
⑤常用海水淡化:_______________________;⑥油水分离:___________________;
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
(12分)某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.
方案Ⅰ.甲组同学用质量法,按如下图所示的实验流程进行实验:

(1)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的仪器是
(2)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,你认为对或错 ,为什么
(3)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为 .(保留3位有效数字)
(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数 (填偏大 偏小 无影响).
方案Ⅱ:乙组同学的主要实验流程图如下:
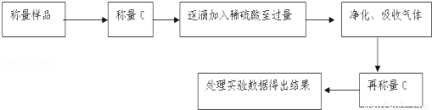
按如下图所示装置进行实验:
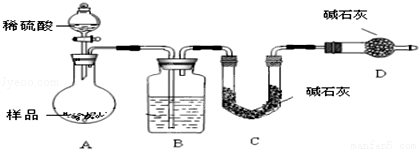
(5)在C中装碱石灰来吸收净化后的气体.D装置的作用是 .
(6)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是 .
方案Ⅲ:气体分析法
(7)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用 (以下选项中选择)使测量误差较小.
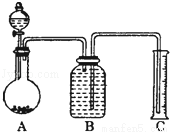
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液
C.饱和氢氧化钠溶液 D.饱和硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.10 L 0.l mol?L-1的Na2CO3溶液中离子总数一定大于3NA
B.标准状况下,22.4 L HF的分子数为NA
C.1 mol Fe在22.4 L的Cl2(标准状况下)中燃烧,转移的电子总数为3NA
D.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第三次模拟化学试卷(解析版) 题型:选择题
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
V3++ VO2++H2O VO2++2H++V2+ 下列说法正确的是
VO2++2H++V2+ 下列说法正确的是
A.放电时每转移2mol电子时,消耗1mol氧化剂
B.放电时正极反应为:VO+2+2H++e—=VO2++H2O
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区移向阳极区迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com