
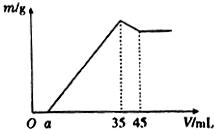
 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )| A. | 3.50mol/L | B. | 1.75mol/L | C. | 0.85mol/L | D. | 无法计算 |
分析 由图象可知,当加入NaOH溶液的体积为35ml时,沉淀的质量达到最大值,则此时溶液的溶质只有Na2SO4,根据Na元素守恒计算.
解答 解:当加入NaOH溶液的体积为35ml时,n(NaOH)=0.035L×10mol/L=0.35mol,
此时沉淀的质量达到最大值,则此时溶液的溶质只有Na2SO4,
根据Na元素守恒,
则有:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.35mol=0.175mol,
c(H2SO4)=$\frac{0.175mol}{0.1L}$=1.75mol/L,
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,本题做题时根据反应判断沉淀最大值时,溶液的溶质,结合质量守恒计算,可省去中间繁杂的计算过程.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在热化学方程式中,物质化学式前面的化学计量数可以为整数也可以为简单分数 | |
| B. | 同一化学反应,热化学方程式中物质的化学计量数不同,反应的△H也不同 | |
| C. | 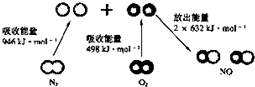 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 | |
| D. | 化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH和 CH3CH(OH)CH3 | |
| B. | CH3CH(CH3)2和CH3CH2CH2CH3 | |
| C. | CH3CH2OH和CH3OCH3 | |
| D. | CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
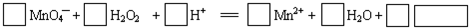
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属性X<Y<Z | |
| B. | 气态氢化物的热稳定性按X、Y、Z顺序减弱 | |
| C. | X、Y、Z的最高价氧化物对应水化物酸性由弱到强 | |
| D. | X、Y、Z最外层电子数依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 | |
| D. | Li、Na、K的原子半径和密度随原子序数的增加而增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com