
| 族 周 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
分析 (1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)主族元素周期数=电子层数、主族族序数=最外层电子数,根据最外层电子数确定最高化合价,书写氧化物化学式;共价键是原子间以共用电子对形成的化学键,大多非金属元素之间形成的键是共价键,活泼金属和活泼的非金属之间形成的键大多是离子键,离子晶体中含有离子键,SiO2是原子晶体,只存在共价键;
(4)单质与氢气反应越剧烈,化学性质越活泼;氧化剂氧化性强于氧化产物氧化性.
解答 解:(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中金属性最强的为K,非金属性最强的元素为F;稀有气体Ne原子最外层为稳定结构,化学性质最不活泼,
故答案为:K;F;Ne;
(2)金属性K>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性KOH>Mg(OH)2,
故答案为:大于;
(3)Si元素原子核外电子数为14,有3个电子层,最外层电子数为4,处于第三周期ⅣA族,最外层电子数最高化合价为+4,最高价氧化物化学式为SiO2,SiO2是原子晶体,硅原子和氧原子间形成的是共价键,
故答案为:三;ⅣA;SiO2;共价键;
(4)氢气与氧气点燃燃烧,而氢气与氯气在光照下发生爆炸,说明氯气与氢气反应更剧烈,化学性质活泼性:O2<Cl2;Cl2+2NaBr=Br2+2NaCl中氯气为氧化剂,溴为氧化产物,故氧化性Cl2>Br2,
故答案为:小于;大于.
点评 本题考查元素周期表与元素周期律,注意掌握金属性、非金属性强弱比较规律及实验事实、注意化学键的形成规律,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 把相同大小的Al和Mg分别投入相同浓度的NaOH溶液中:Al溶解有气泡放出,而Mg没有任何变化.由此得出:Al的金属性比镁强 | |
| B. | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落.由此得出:铝不能燃烧 | |
| C. | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡.由此得出:该气体一定是氨气 | |
| D. | 向AlCl3溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失.由此得出:Al(OH)3能溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铂丝蘸取少量A溶液于酒精灯上灼烧,透过钴玻璃,可观察到蓝色火焰 | |
| B. | A溶液中存在c(K+)+c(NH4+)+3 c(Fe3+)=2 c(SO42-)+c(Cl-) | |
| C. | y+z=16 | |
| D. | 若④中沉淀灼烧不充分,将导致z偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
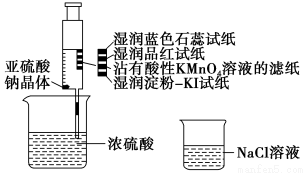
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com