
| A. | 氟原子的结构示意图: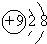 | B. | 乙烯结构式:CH2=CH2 | ||
| C. | 乙炔球棍模型: | D. | NH3的电子式: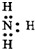 |
分析 A.氟原子的核电荷数=核外电子总数=9,最外层为7个电子;
B.乙烯的结构式需要将所有的共用电子对用短线代替;
C.乙炔为直线型结构,碳原子半径大于氢原子,据此判断乙炔的球棍模型;
D.氨气为共价化合物,氮原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对.
解答 解:A.氟原子的最外层含有7个电子,氟原子正确的原子结构示意图为: ,故A错误;
,故A错误;
B.乙烯分子中含有4个碳氢键和1个碳碳双键,乙烯正确的结构式为: ,故B错误;
,故B错误;
C.乙炔分子中含有两个碳氢键和1个碳碳三键,乙炔的球棍模型为: ,故C正确;
,故C正确;
D.氨气分子中含有3个氮氢键,氮原子最外层达到8电子稳定结构,氨气正确的电子式为: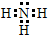 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及球棍模型、原子结构示意图、电子式、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
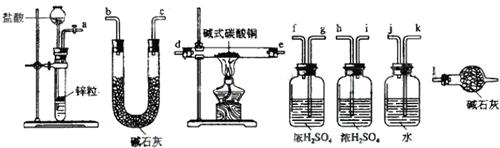
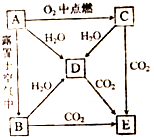 A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题:
A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题: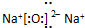 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2是芳香族化合物(R、R′代表烃基,X代表卤素原子),相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2是芳香族化合物(R、R′代表烃基,X代表卤素原子),相对分子质量为175,其中X元素的质量分数为40.6%. .
. +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$ +2nH2O.
+2nH2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
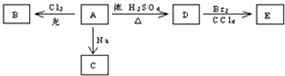
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化: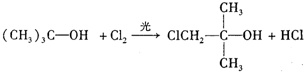 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com