
【题目】有机物F(C21H20O6)在临床医学上具有预防肿瘤的作用,其合成路线如下:其中反应③中反应物的原子利用率为100%。
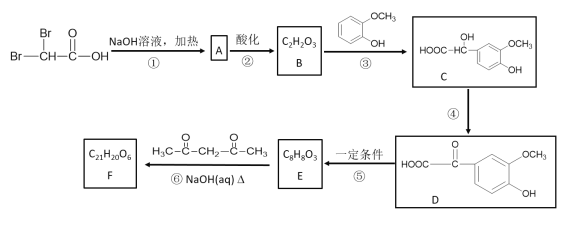
已知:
请回答下列问题:
(1)B中含有的官能团名称是___________。③的反应类型为__________。
(2)反应①的化学方程式是________________。反应④的化学方程式是___________。
(3)E的结构简式是______________。F的结构简式是__________________。
(4)E的同分异构体中,同时符合下列两个条件的共有种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为______________。
①苯环上的一取代物只有2种;
②1 mol该物质与足量NaOH溶液反应时,反应消耗3 mol NaOH
【答案】(1)醛基、羧基,取代反应;
(2)![]() +3NaOH
+3NaOH![]()
![]() +2NaBr+2H2O;
+2NaBr+2H2O;
2 +O2
+O2![]() 2
2![]() +2H2O;
+2H2O;
(3) 、
、 ;
;
(4)5; 。
。
【解析】
试题分析:反应①在碱性条件下发生卤原子的水解,根据信息(1),则A的结构简式为:![]() ,反应②酸化,利用酸性强的制取弱的,则B的结构简式为:
,反应②酸化,利用酸性强的制取弱的,则B的结构简式为:![]() ,D的分子式为C9H8O5,对比D和E的结构简式,以及根据(2),反应⑤去掉一个CO2,(1)根据上述推断,B中含有的官能团是醛基和羧基,B、C结构简式的对比,发生的反应类型是加成反应;(2)反应①是卤原子的水解反应和中和反应,以及信息(1),其反应方程式为:
,D的分子式为C9H8O5,对比D和E的结构简式,以及根据(2),反应⑤去掉一个CO2,(1)根据上述推断,B中含有的官能团是醛基和羧基,B、C结构简式的对比,发生的反应类型是加成反应;(2)反应①是卤原子的水解反应和中和反应,以及信息(1),其反应方程式为:![]() +3NaOH
+3NaOH![]()
![]() +2NaBr+2H2O;对比C、D结构简式,发生的是氧化反应,即反应④的方程式为2
+2NaBr+2H2O;对比C、D结构简式,发生的是氧化反应,即反应④的方程式为2 +O2
+O2![]() 2
2![]() +2H2O;(3)反应⑤是利用信息(2)失去一个CO2,其E的结构简式为:
+2H2O;(3)反应⑤是利用信息(2)失去一个CO2,其E的结构简式为: ,利用信息(3)F的结构简式为:
,利用信息(3)F的结构简式为: ;(4)有4组吸收峰,说明有4种不同化学环境的氢原子,苯环上的一氯代物有2种,说明是对称结构,能消耗3molNaOH,则该有机物的结构简式为
;(4)有4组吸收峰,说明有4种不同化学环境的氢原子,苯环上的一氯代物有2种,说明是对称结构,能消耗3molNaOH,则该有机物的结构简式为 。
。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】I.用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如图所示的催化剂循环实现,
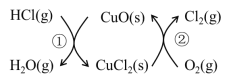
其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(反应热用△H1和△H2表示)。
II.氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s) + SO2(g)=ZnSO3(s),试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②_______________________;
(2)已知:纯ZnO的悬浮液pH约为6.8。用氧化锌吸收法脱去烟气中SO2的过程中,测得pH、吸收效率η随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
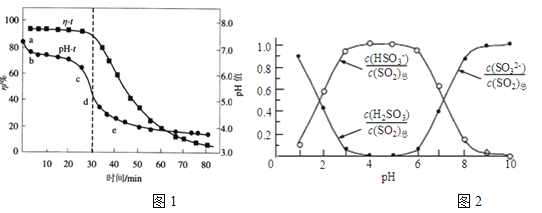
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;
④为提高SO2的吸收效率η,可采取的措施为___________。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(3)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
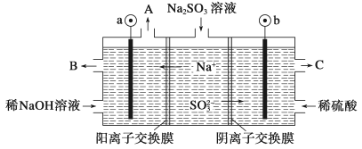
b极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
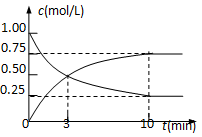
①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用高效催化剂
D.恒温恒容再充入1 mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为2.0 mol/L的CuSO4溶液。
①配制950 mL 2.0 mol/L的CuSO4溶液应称取胆矾的质量为____ ___g。
②某学生实际配制CuSO4溶液的浓度为1.8 mol/L,原因可能是__ ___。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)写出用上述方法制备CuCl的离子方程式_____ ____。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是 ; _。(回答两点)
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是____ __ ___。
A. 氧化产物是HO2
B. HO2在碱中能稳定存在
C. HO2的电离方程式是HO2![]() H+ + O2-
H+ + O2-
D. 1mol Cu 参加反应有2mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2) 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
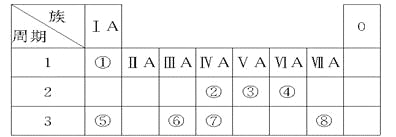
(1) 由②和④组成,造成温室效应的气体的结构式是________
(2) ①、④、⑤、⑧中的某些元素可形成多种既含离子键又含共价键的化合物,写出其中一种化合物的电子式: 。
(3) ④、⑤、⑥的原子半径由大到小的顺序为(填元素符号) 。
(4) ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式) 。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
![]()
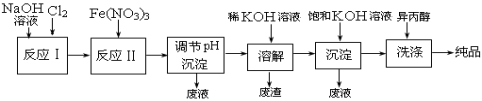
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。
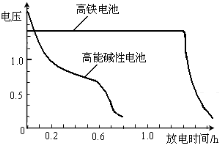
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物种类较多,也大多具有广泛的用途。
I. MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:

①从以上实验中,我们可以得出的结论是_________________________________。
②写出C试管中发生反应的离子方程式:_________________________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:

已知Fe3+、Mn2+沉淀的pH为上表所示。
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_____________________。
②步骤二中需控制pH的范围是 ___________ 。
③步骤三中是否洗涤干净的判断方法是 _______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的说法正确的是
A.液态HCl不导电,所以HCl不是电解质
B.NH3溶于水形成的溶液能导电,所以NH3是电解质
C.稀硫酸能导电,所以稀硫酸是电解质
D.BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com