
| A | B | C | D | |
| 物质名称 | 氯气 | 小苏打 | 二氧化硅 | 氧化铁 |
| 用途 | 制漂白粉 | 治疗胃酸过多 | 制半导体材料 | 用作红色涂料 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气和消石灰反应生成氯化钙、次氯酸钙和水,是工业制备漂白粉的物质;
B.小苏打是碳酸氢钠,可以和胃液中的盐酸发生反应;
C.二氧化硅是光导纤维的成分,半导体是利用硅晶体的导电性制备;
D.氧化铁为红色不溶于水的固体氧化物,性质稳定.
解答 解:A.氯气和消石灰反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,用于工业制备漂白粉,故A正确;
B.小苏打是碳酸氢钠,可以和胃液中的盐酸发生反应,治疗胃酸过多,故B正确;
C.制备半导体是利用硅晶体的导电性,二氧化硅是光导纤维的成分,故C错误;
D.氧化铁为红色不溶于水的固体氧化物,性质稳定,可以制作红色涂料,故D正确;
故选C.
点评 本题主要考查物质的性质和用途,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 钠块沉在乙醇液面下面 | B. | 钠块熔成小球 | ||
| C. | 钠块在乙醇液面上游动 | D. | 钠块表面无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3═2Na++CO32- | B. | H2O═2H++O2- | ||
| C. | HNO3═H++NO3- | D. | K2SO4═2K++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
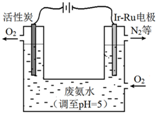 过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.
过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
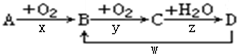
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑥ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com