
(1)在实验过程中水的电离程度的变化趋势是先____________后____________(填“增大”“减小”或“不变”)。
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
编号 | 离子浓度大小顺序 | 溶质的化学式 | 溶液的pH |
① | c( |
| pH>7 |
② | c( | NH4Cl和NH3·H2O |
|
③ |
| NH4Cl | pH<7 |
④ | c(Cl-)>c(H+)>c( |
| pH<7 |
(1)增大 减小
(2)①NH3·H2O和NH4Cl ②pH=7 ③c(Cl-)>c(![]() )>c(H+)>c(OH-) ④HCl和NH4Cl
)>c(H+)>c(OH-) ④HCl和NH4Cl
解析:(1)酸和碱都抑制水的电离,弱盐则促进水的电离。开始时属于碱的氨水的消耗和属于弱盐的NH4Cl的生成都使水的电离程度增大,后来属于酸的盐酸过量,导致水的电离程度又减小。(2)由①中c(OH-)>c(H+)可知氨水没有反应完全,溶质为NH3·H2O和NH4Cl。②中据溶液呈电中性列出的等式为c(H+)+c(![]() )=c(OH-)+c(Cl-),由c(
)=c(OH-)+c(Cl-),由c(![]() )=c(Cl-)得c(H+)=c(OH-),相应pH=7。③中
)=c(Cl-)得c(H+)=c(OH-),相应pH=7。③中![]() 因部分水解而减少,NH4Cl溶液中离子浓度相对大小关系为c(Cl-)>c(
因部分水解而减少,NH4Cl溶液中离子浓度相对大小关系为c(Cl-)>c(![]() )>c(H+)>c(OH-)。④中c(H+)>c(
)>c(H+)>c(OH-)。④中c(H+)>c(![]() ),可知HCl已过量,则溶质为HCl和NH4Cl。
),可知HCl已过量,则溶质为HCl和NH4Cl。


科目:高中化学 来源: 题型:
| 离子浓度的关系 | 溶质的化学式 | 溶液的pH | |
| ① | [NH4+]>[Cl-]>[OH-]>[H+] | pH>7 | |
| ② | [NH4+]=[Cl-] | NH4Cl、NH3?H2O | |
| ③ | NH4Cl | pH<7 | |
| ④ | [Cl-]>[H+]>[NH4+>[OH-] | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。请回答下列问题。
(1)在实验过程中水的电离程度的变化趋势是先_______后________;(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
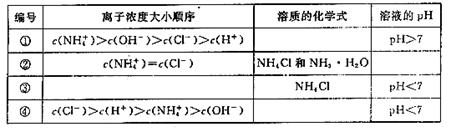
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:填空题
(10分)CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) 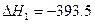 kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) 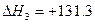 kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的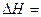 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) 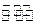 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。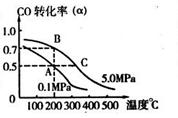
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省聊城市临清三中高二(上)期末化学模拟试卷(理科)(解析版) 题型:解答题
| 离子浓度的关系 | 溶质的化学式 | 溶液的pH | |
| ① | [NH4+]>[Cl-]>[OH-]>[H+] | ______ | pH>7 |
| ② | [NH4+]=[Cl-] | NH4Cl、NH3?H2O | ______ |
| ③ | ______ | NH4Cl | pH<7 |
| ④ | [Cl-]>[H+]>[NH4+>[OH-] | ______ | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com