
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是
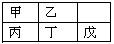
A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:2017届江苏省苏州市高三上学期期末考试化学试卷(解析版) 题型:简答题
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g) = CO2(g)+2H2O(1) △H1=akJ•mol-1
O2(g) = CO2(g)+2H2O(1) △H1=akJ•mol-1
H2(g)+ O2(g) = H2O(1) △H2=bkJ•mol-1
O2(g) = H2O(1) △H2=bkJ•mol-1
H2O(g) = H2O(l) △H3=ckJ•mol-1
则 CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=__________kJ•mol-1
CH3OH(g)+H2O(g) △H=__________kJ•mol-1
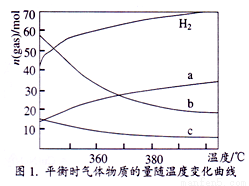
(2)CO2催化加氢也能合成低碳烯烃: 2CO2(g)+6H2(g) C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。
C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应 A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+ H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
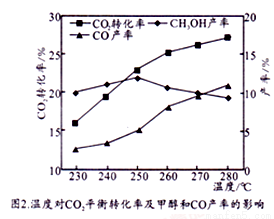
① 由图2可知温度升高CO的产率上升,其主要原因可能是__________________。
② 由图2可知获取CH3OH最适宜的温度是________________,下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有__________________。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(4)在催化剂表面通过施加电压可将溶解在水中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为______________________________________________________。
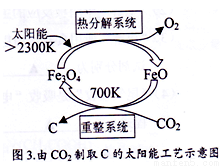
(5)由CO2制取C的太阳能工艺如图3所示。“热分解系统”发生的反应为:2Fe3O4 6FeO+O2↑ ,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
6FeO+O2↑ ,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:选择题
下列实验装置、试剂选用及实验操作都正确的是
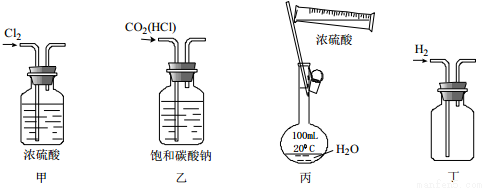
A. 用甲干燥Cl2 B. 用乙除去CO2中的HCl
C. 用丙配制一定浓度的H2SO4 D. 用丁收集一瓶H2
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
下列有关纯碱和小苏打的叙述中正确的是 ( )
A. Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B. 等质量Na2CO3、NaHCO3分别与相同浓度的盐酸反应,NaHCO3消耗的盐酸体积少
C. 向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D. 等物质的量Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g)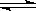 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amol A,同时生成3amol B;
③B的浓度不再变化; ④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1:3:3; ⑥混合气体的密度不再变化;
A. ①③⑥ B. ①③④⑥ C. ①②③ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A. 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔
B. 海水中含有丰富的碘元素,因此碘被称为“海洋元素”
C. 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色
D. 用蒸馏的方法可将CCl4和Br2的混合物分开
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是( )
实验内容 | 实验目的 | |
A | 向1 mL 0.1mol/L NaOH溶液中加入2 mL 0.1mol/L CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热未出现红色沉淀 | 证明葡萄糖中含有醛基 |
B | 向1 mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2 溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 测定同温度下相同浓度的碳酸钠和硫酸钠溶 液的pH,前者大于后者 | 证明碳元素非金属性弱于硫 |
D | 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊 试纸置于试管口试纸不变蓝 | 证明溶液中无NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:选择题
下列各项中所列举的物质与所属类别对应不正确的是
A. 酸性氧化物: 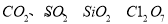
B. 非电解质:蔗糖、四氯化碳、氨气、氯气
C. 同素异形体:石墨与金刚石、单斜硫与斜方硫
D. 混合物:铝热剂、纯净矿泉水、水玻璃、焦炉气
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:简答题
硫代硫酸钠(Na2S2O3)是一种常用的化工原料,常用作除氯剂等。回答下列问题:
(1)硫代硫酸钠中所含的化学键类型为_______________________。
(2)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是________________。
(3)实验测定Na2S2O3溶液呈弱碱性,用离子方程式解释其主要原因:__________,25℃时该离子反应的平衡常数值约为__________________
【已知:25℃时K1(H2S2O3)=2.52×10-1mol/L,K2(H2S2O3)=1.02xl0-2mol/L】
(4)实际生产中,一般将Na2S和Na2CO3以物质的量比2∶1配成溶液后加热,将SO2缓缓通入溶液中,即可得到硫代硫酸钠。反应的化学方程式为_______________________。
(5)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯需要0.56g硫代硫酸钠。硫代硫酸钠作除氯剂的主要原因是其具有_________性,反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com