
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 | |
| B. | 升高温度能够增大单位体积内活化分子百分数,从而加快反应速率 | |
| C. | 中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和量筒三种 | |
| D. | 强电解质的导电能力一定比弱电解质强 |
分析 A.SO3溶于水后能导电,但不是SO3电离出的离子;
B.升高温度,给分子提供能量,活化分子百分数增大,有效碰撞次数增加;
C.依据中和热试验简易装置解答;
D.溶液导电能力取决于溶液中离子浓度的大小,与电解质强弱无关.
解答 解:A.SO3溶于水后能导电,但不是SO3电离出的离子,是非电解质,故A错误;
B.升高温度,给分子提供能量,活化分子百分数增大,有效碰撞次数增加,则反应速率加快,故B正确;
C.中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和环形玻璃棒搅拌棒三种,故C错误;
D.电解质导电能力与自由移动的离子浓度成正比,与电解质的强弱无关,故D错误;
故选B.
点评 本题为综合题,考查了电解质的判断、影响反应速率的因素、中和热测定、溶液的导电性等,熟悉相关知识是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
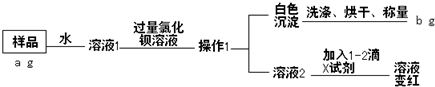
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把a L0.1mol•L-1的CH3COOH溶液与bL 0.1mol•L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol•L-1的NaHCO3溶液与0.3mol•L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| C. | 向1mol•L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② | |
| B. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| C. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| D. | ②和③混合,所得混合溶液的pH大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| B. | 金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
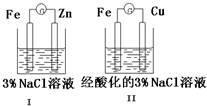
| A. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极均被保护 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和FeSO4溶液使酸性高锰酸钾的紫色退去 | |
| B. | Cl2和SO2都能使品红溶液褪色 | |
| C. | 常温下铁和金都不溶于浓硝酸 | |
| D. | 漂白粉和水玻璃长期暴露会变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中N0的物质的量为0.01mol | |
| B. | 混合气体中N02的物质的量为0.02mol | |
| C. | 稀硝酸的浓度为0.045mol/L | |
| D. | 氢氧化钠溶液的浓度为0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com