
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
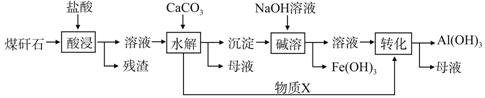
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为__________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:
【知识点】铁、铝的重要化合物;难溶电解质的溶解平衡 C2 C3 H5
【答案解析】(1)Al2O3+6H+===2Al3++3H2O 【 或Fe2O3+6H+===2Fe3++3H2O 】
(2)CO2 Al(OH)3+OH-===AlO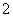 +2H2O
+2H2O
(3)加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后
(4)AlCl3饱和溶液中存在溶解平衡AlCl3·6H2O(s) Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl气体使溶液中的c(Cl-)增大,平衡向析出固体的方向移动,从而析出AlCl3·6H2O晶体。
Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl气体使溶液中的c(Cl-)增大,平衡向析出固体的方向移动,从而析出AlCl3·6H2O晶体。
解析:(1)氧化铝和氧化铁都能和盐酸反应生成盐和水,反应方程式分别是:Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O
(2)氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,氢氧化铝和氢氧化钠溶液反应生成可溶性偏铝酸钠,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O
(3)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,要使铁离子完全沉淀而铝离子不沉淀,则溶液的PH应该为3.2,过滤氢氧化铝沉淀时调节溶液pH为5.4,以使氢氧化铝完全沉淀
(4)氯化铝在溶液中存在溶解平衡,通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,故答案为:AlCl3饱和溶液中存在溶解平衡:
AlCl3•6H2O(s)⇌Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
【思路点拨】本题以工艺流程为载体考查了溶解平衡原理、物质间的反应、除杂等知识点,这种题型是高考常考题型,综合性较强,涉及知识面较广,用教材基础知识采用知识迁移的方法分析解答,难度中等。


科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的。
已知: 氧化性: IO3— >Fe3+ >I2 还原性:S2O32— > I—
反应式:3I2 + 6OH— == 5I— + IO3— + 3H2O KI + I2 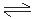 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)。用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色。
① 该红色物质是 (用化学式表示);CCl4中显示紫红色的物质是 (用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为 ; 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A. Na2S2O3 B. AlCl3 C. Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。回答有关问题。
(1)干电池的基本构造和工作原理
如图为干电池的基本构造图。干电池工作时负极上的电极反应是
__________________________,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2===Mn2O3+H2O。
(2)锌皮和碳棒的回收
用钳子和剪子剪开待回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②设计简单的实验证明所得晶体中含有NH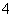 。
。
实验步骤
________________________________________________________________________
________________________________________________________________________;
实验现象
________________________________________________________________________;
有关的离子方程式
________________________________________________________________________。
③用________的方法可将NH4Cl和ZnCl2的晶体混合物分离开。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中要用到的主要仪器有
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是
A.氯化亚铁溶液中加入双氧水 B.硫酸铁溶液中滴加硫氰酸钾溶液
C.硫酸铜溶液中滴加硝酸钡溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示装置进行铁和水蒸气反应的实验。
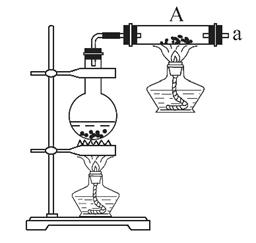
(1)铁粉与水蒸气反应的化学方程式是: ;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能证明气体产物的实验现象_ ;

(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法: ;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用化学方程式说明): ;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置: 通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合 ③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )
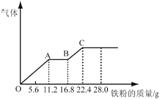 A.混合酸中HNO3物质的量浓度为2 mol·L-1
A.混合酸中HNO3物质的量浓度为2 mol·L-1
B.原混合酸中H2SO4物质的量为0.4 mol
C.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,
BC段产生氢气
D.第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
英国《卫报》最近评出了“人类最糟糕的发明”,我们使用的塑料袋不幸获得这一殊荣,这是因为它对生态环境造成了严重污染,为了防治污染,有一条重要的途径是将合成高分子化合物重新变成小分子化合物,目前对结构简式为:
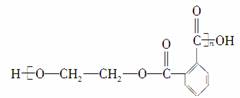 的物质已经成功地实现了这种处理,试分析若用CH3OH来处理它,能得到的有机物可能是( )
的物质已经成功地实现了这种处理,试分析若用CH3OH来处理它,能得到的有机物可能是( )
① 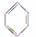 ②HOCH2CH2OH
②HOCH2CH2OH
③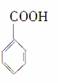 ④
④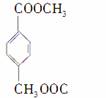
A.①④ B.②④ C.②③ D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com