
【题目】现有 A、B、C、D、E 五种短周期元素,已知 A、B、C、D 四种元素的核内质子数 之和为 56,在元素周期表中的位置如图所示,1 mol E 的单质可与足量酸反应,能产生 33.6 L H2(在标准状况下);E 的阳离子与 A 的阴离子核外电子层结构相同。回答下列问题:

(1)写出下列元素名称 A_______,B_______, E_______
(2)C 的简单离子结构示意图为_______
(3)A 与 E 形成的化合物的化学式为_______,它的性质决定了它在物质的分类中应属于_______
(4)D 和 E 形成化合物在熔融状态下不导电,原因是______。
(5)向 D 与 E 形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是______,写出有关化学反应方程式______。
【答案】氧 磷 铝 S2:![]() Al2O3 两性氧化物 无自由移动的离子 先出现白色沉淀,后白色沉淀消失 AlCl3+3NaOH=Al(OH) 3↓+ 3NaCl,Al(OH) 3+NaOH=NaAlO2+2H2O
Al2O3 两性氧化物 无自由移动的离子 先出现白色沉淀,后白色沉淀消失 AlCl3+3NaOH=Al(OH) 3↓+ 3NaCl,Al(OH) 3+NaOH=NaAlO2+2H2O
【解析】
设C的序数为x,则A为x-8,B为x-1,D为x+1,有x+ x-8+ x-1+ x+1=56,x=16,则A为氧,B为磷,C为硫,D为氯。1mol E 的单质可与足量酸反应,能产生 33.6 L H2(在标准状况下),则一个E失去三个电子转化为阳离子,与O2核外电子层结构相同,故E为铝。
(1)根据分析,A是氧,B磷,E为铝;
(2)硫的简单离子结构示意图为S2:![]()
(3)氧元素与氯元素形成的化合物的化学式为Al2O3,因为既能与酸反应生成相应的盐和水,又可以与碱反应生成相应的盐和水,所以它的性质决定了它在物质的分类中应属于两性氧化物;
(4)氯元素和铝元素形成化合物AlCl3是共价化合物,由分子组成,无离子,故在熔融状态下不导电的原因是无自由移动的离子;
(5)向AlCl3溶液中滴入烧碱溶液,生成Al(OH) 3白色沉淀,滴加至过量,生成的氢氧化铝会溶解,生成NaAlO2,所以此过程中观察到的现象是先出现白色沉淀,后白色沉淀消失;有关反应方程式AlCl3+3NaOH=Al(OH) 3↓+ 3NaCl,Al(OH) 3+NaOH=NaAlO2+2H2O。


科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。则下列说法不正确的是( )
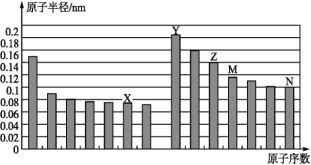
A.Z、N两种元素的离子半径相比,后者较大
B.X、N两种元素的气态氢化物的稳定性相比,前者较强
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氢氧化物能分别溶解于Y的氢氧化物的水溶液和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知甲烷的燃烧热为890.3 kJ·mol-1,写出表示甲烷燃烧热的热化学方程式:__________________________
(2)如图是一个电化学过程的示意图,据图回答下列问题:
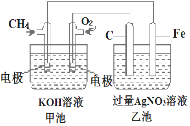
①甲池是___________________装置。
②请回答电极的名称:Fe电极的电极名称是__________
③写出电极反应式:通入CH4的电极反应式是__________________________;Fe电极的电极反应式为______________________
④乙池中反应的化学方程式为___________________________;当乙池中石墨(C)电极上生成的气体体积在标准状况下为112mL时,200mL AgNO3溶液(设乙池溶液的体积变化可以忽略)的pH值=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上制备高纯硅通常第一步是利用石英砂和焦炭在电弧炉中制粗硅,则该反应的化学方程式是______。
(2)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
步骤Ⅰ:打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加浓盐酸。
步骤Ⅱ:A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ知浓盐酸具有的性质是_________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是_______(填化学式),D中试剂瓶的现象是___。
③该同学用图中所示装置进行实验验证碳和硅两种元素非金属性的相对强弱的理论依据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法不正确的是( )

A.温度为78 ℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380 ℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159 ℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成CH3OH的原理为:2H2(g)+CO![]() CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
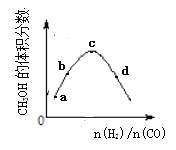
A. 相同条件下,达到平衡时混合气体的密度与反应前相同
B. a、b、c、d四点中,c点CO的转化率最大。
C. 若投料时n(CO)不变,a、b、c、d四点中d处CH3OH的物质的量最大
D. 图像中 c点到d点,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出解释下列事实的离子方程式:
(1)FeCl3水溶液呈酸性:_________
(2)用Na2CO3溶液浸泡含有CaSO4的水垢:_________
(3)用稀硫酸酸化的KI淀粉溶液在空气中久置后变蓝:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
A.由反应可推断氧化性:HClO4<HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5Cl2+I2+6H2O═12H++10Cl-+2IO3-
C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com