
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等. ,工业上电解熔融的氧化铝冶炼Al,反应方程式为:2Al2O3
,工业上电解熔融的氧化铝冶炼Al,反应方程式为:2Al2O3
| ||
| 冰晶石 |
 ;2Al2O3
;2Al2O3
| ||
| 冰晶石 |


科目:高中化学 来源: 题型:
| A、Ag+、NO3-、Cl-、Na+ |
| B、Na+、Ba2+、Mg2+、NO3- |
| C、OH-、K+、HCO3-、Ba2+ |
| D、H+、CO32-、K+、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数小于0.1 NA |
| B、常温常压下,8.8gCO2和N2O混合物中所含有的原子数为0.6NA |
| C、室温下,8 g甲烷含有共价键数为2 NA |
| D、标准状况下,27g铝与22.4L的氯气充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | A | B | C | D | E | F | G | H |
| 物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究:
某化学兴趣小组在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究:
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | a | e | H |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
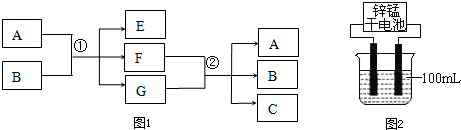
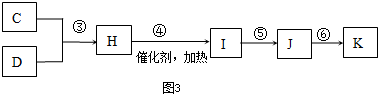
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1H2S溶液:c(H+)>c(OH-) |
| B、0.1 mol?L-1 NH4Cl溶液:c(H+)=c(OH-) |
| C、在0.1 mol?L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+) |
| D、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com