
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若分别加入25mL0.1mol•L-1盐酸,反应后pH最大的是① | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
分析 A.碱溶液pH最大,盐溶液中,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大;
B.等物质的量反应,碳酸钠反应生成碳酸氢钠和氯化钠,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠和盐酸反应生成氯化钠和水;
C.稀释相同的倍数,促进含有弱离子盐的水解,pH变化最大的是强碱;
D.pH相等的这三种溶液,强碱的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小.
解答 解:A.碱溶液pH最大,盐溶液中,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大,碳酸氢根离子水解程度小于碳酸根离子,所以这三种溶液pH大小顺序是:③>①>②,故A错误;
B.若分别加入相同物质的量的HCl,HCl和NaOH恰好完全反应生成NaCl,溶液呈中性,碳酸钠和HCl恰好完全反应生成碳酸氢钠和氯化钠,溶液呈碱性,和碳酸氢钠恰好完全反应生成氯化钠,水和二氧化碳,溶液呈中性,所以pH最大的是①,故B正确;
C.稀释相同的倍数,促进含有弱离子盐的水解,强碱完全电离,所以pH变化最大的是强碱③,故C错误;
D.pH相等的这三种溶液,强碱的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小,碳酸氢根离子水解程度小于碳酸根离子,所以若3种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③,故D错误;
故选B.
点评 本题考查了pH的简单计算、盐类水解等知识点,明确弱酸根离子的水解程度与酸的酸性强弱的关系是解本题关键,再结合物质的性质分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤②④ | C. | ②⑤①③④ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )| A. | W的非金属元素比Z的弱 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | Y的原子半径在同周期主族元素中最大 | |
| D. | Z的气态氢化物的稳定性在同主族元素中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
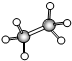 ;B的比例模型为
;B的比例模型为 ;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. ,CCH4,DCH3CH2OH.
,CCH4,DCH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b<a<0 | B. | b>d>0 | C. | 2a=d>0 | D. | 2b=c<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
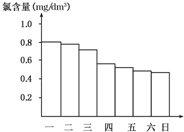 某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )
某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )| A. | 周一 | B. | 周二 | C. | 周三 | D. | 周四 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
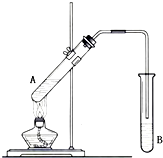 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com