
| A. | Al2(SO4)3可以除去酸性废水中的悬浮颗粒 | |
| B. | 高锰酸钾溶液和双氧水进行环境消毒时原理是相同的 | |
| C. | 雾霾中含有大量超标的主要物质是SO2 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
分析 A.酸性条件下抑制Al2(SO4)3水解,不能达到氢氧化铝胶体;
B.高锰酸钾溶液和双氧水都具有氧化性,能够使蛋白质变性;
C.雾霾是因空气中增加了大量的可吸入颗粒物;
D.铜活泼性排在氢的后面,酸性环境下不能与氢离子反应生成氢气.
解答 解:A.酸性条件下抑制Al2(SO4)3水解,不能生成氢氧化铝胶体,所以不能除去酸性废水中的悬浮颗粒,故A错误;
B.高锰酸钾溶液和双氧水都具有氧化性,能够使蛋白质变性,二者都能用于环境消毒,且原理相同,故B正确;
C.雾霾中含有大量超标的主要物质是大量的可吸入固体颗粒物,不是二氧化硫,故C错误;
D.铜活泼性排在氢的后面,不能发生析氢腐蚀,故D错误;
故选:B.
点评 本题考查了化学与生活中的环境污染,题目难度中等,掌握明矾净水原理、雾霾、物质的性质是解题关键,试题培养了学生的分析、理解能力,增强了环境保护意识.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:选择题
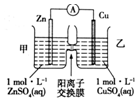
| A. | 锌电极上发生的反应: | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 电流由锌电极经电流表流向铜电极 | |
| D. | 电池工作一段时间后,乙池溶液的总质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量浓盐酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
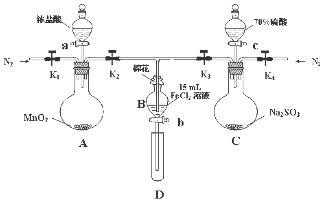 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应伴随能量变化,是化学反应的基本特征之一 | |
| B. | 常温下,氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为放热反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 旧化学键断裂所放出的能量高于新化学键形成所吸收的能量时发生放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
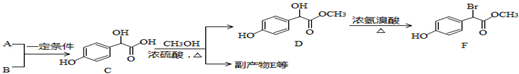
 ;
;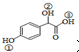 )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.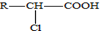 .A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.
.A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com