
[物质结构与性质]
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。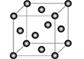
科目:高中化学 来源: 题型:填空题
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):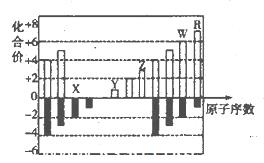
(1)元素x、Y、z、W、R五种元素中属于金属元素的是___________;Z的简单离子的结构示意图是___________。
(2)由此图可以判断,11种元素中处于同主族的共有____________组。
(3)X、Y.Z三种元素的原子半径大小顺序为___________;它们的离子的半径大小顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BeO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
| | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。 请完成下列填空:
(1)10Be和9Be 。(填序号)
a.具有相同的化学性质 b.Be 元素的近似相对原子质量是9.5
c.具有相同的中子数 d.通过化学变化可以实现10Be和9Be间的相互转化
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是 。(填序号)
a.比较这两种元素的单质的硬度和熔点
b.将空气中放置已久的这两种元素的单质分别和热水作用
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
(3)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序 (用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干操剂,此化合物的电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | | ⑧ | |
| 4 | ⑨ | ⑩ | | | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com