
| A、H+、Ca2+、Fe3+、NO3- |
| B、Ba2+、ClO-、Na+、OH- |
| C、Na+、NH4+、I-、HS- |
| D、Na+、Ca2+、K+、Cl- |


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
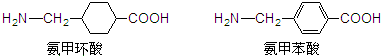
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射 | 有丁达尔效应 | 微蓝色液体为胶体 |
| B | 将FeSO4高温强热,得红色固体,产生的气体通入BaCl2溶液 | 产生白色沉淀 | 白色沉淀为BaSO4和BaSO3 |
| C | 将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀生成 | Y中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾溶液中滴加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O |
| C、小苏打溶液中加足量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、SO2通入FeCl3溶液中:SO2+Fe3++2H2O═SO42-+Fe2++4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
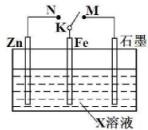
| A、若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-═Cl2↑ |
| B、若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C、若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D、若X为NaCl,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 解释或结论 | ||||
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 | SO2具有漂白性 | ||||
| B | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) | ||||
| C | 某钾盐溶于盐酸,产生无色无味气体,该气体通入澄清石灰水,有白色沉淀出现 | 该钾盐可能是K2CO3 | ||||
| D | NaI溶液
|
酸性条件下H2O2的氧化性比I2强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
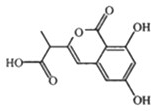
| A、1mol该有机物最多可以和5mol NaOH反应 |
| B、1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
| C、该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
| D、该有机物容易发生加成、取代、中和、消去等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
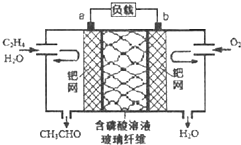 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、每有0.1mol O2反应,则迁移H+0.4mol |
| C、正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O |
| D、电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:
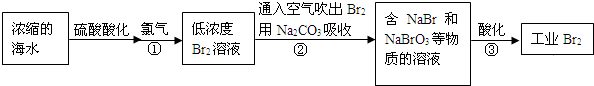
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com