
分析 酸的电离平衡常数越小,其对应的酸根离子水解程度越大,则相同浓度的钠盐溶液的pH越高;
根据电离平衡常数知,酸的电离平衡常数大小顺序是:H2SO3>HSO3->H2CO3>HCO3-,则酸根离子水解程度大小顺序是CO32->HCO3->SO32->HSO3-,弱酸根离子都水解但程度都较小,据此判断各离子浓度大小.
解答 解:H2SO3 Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH;
电离平衡常数:H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11,酸的电离平衡常数大小顺序是:H2SO3>HSO3->H2CO3>HCO3-,则酸根离子水解程度大小顺序是CO32->HCO3->SO32->HSO3-,这些弱酸根离子都水解但程度都较小,所以SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:大于;c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 晶体中不一定存在分子间作用力,但一定存在化学键 | |
| B. | 液态氟化氢中存在氢键,所以其沸点比氯化氢更高 | |
| C. | 向Fe(NO3)2溶液中通入过量的HI,最终Fe2+全部氧化成Fe3+ | |
| D. | 普通玻璃是将石灰石、石英、黏土在玻璃熔炉中高温熔融制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 生成物总能量一定低于反应物总能量 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为:2H2O+O2+4e-═4OH- | |
| C. | 在铁上镀锌时,应让锌作阴极,铁作阳极 | |
| D. | 铝制品不需要特殊的防腐措施原因是铝易于被氧气氧化形成致密的氧化物保护膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
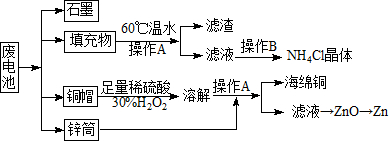 常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 用大理石盐酸反应制取CO2 气体,立即通入一定浓度Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3酸性比H2SiO3酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中一种几种 |
| C | 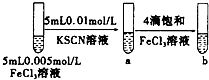 | 试管b比试管a中溶液红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 等体积PH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余NO | B. | 剩余O2 | C. | 剩余NO2 | D. | 不剩余气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com