
下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则
c(OH-)-c(HY)=c(H+)=1×10-5mol/L
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
AD
【解析】
试题分析:根据盐的组成可知,溶质浓度相同时,硫酸铵溶液中的铵根离子浓度比氯化铵溶液中的大,而硫酸亚铁铵溶液中的铵根离子浓度比硫酸铵中小,因为亚铁离子的水解反应能抑制铵根离子的水解,则c(NH4+):(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl,反之,若三种铵盐溶液中c(NH4+)相等,硫酸亚铁铵浓度保持不变时,则氯化铵浓度增大的程度最大,硫酸铵浓度增大的程度其次,所以溶质浓度大小关系为c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故A选项正确;由于n=c•V,则HY和NaOH的物质的量相等,二者恰好完全中和,生成NaY溶液,由于溶液pH=9,即溶液显碱性,说明NaY是强碱弱酸盐、HY是弱酸,相同,由于c(H+)=10—pHmol/L=10—9mol/L,Kw=c(H+)•c(OH-)=10—14,则该碱性溶液中的溶液中c(OH-)=Kw/c(H+)=10—5mol/L,由于NaY溶液中质子守恒关系式为c(OH-)=c(H+)+c(HY)=
10—5mol/L,故B选项错误;强酸与强碱混合时强酸过量,则混合后溶液中c(H+)= =
= mol/L=0.05mol/L,由于pH=—lg c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O
mol/L=0.05mol/L,由于pH=—lg c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O
H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O H2CO3+OH—、HCO3—
H2CO3+OH—、HCO3— H++
CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
H++
CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及盐类水解程度大小关系、盐溶液中质子守恒关系式、溶液的pH、水的离子积等。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
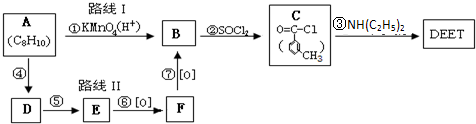
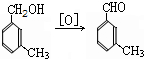
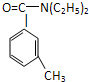 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH| SOCl2 |
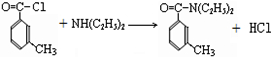
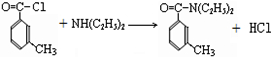

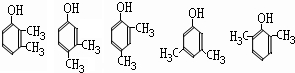 (任写2种)
(任写2种) (任写2种)
(任写2种)

查看答案和解析>>
科目:高中化学 来源: 题型:
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
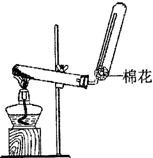 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||
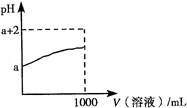
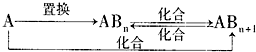
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
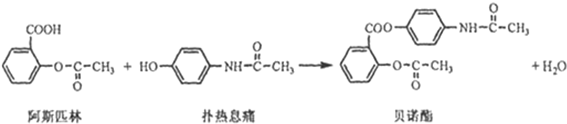
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com