
| A、常温下,将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH=8 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、由0.1mol?L-1一元碱BOH溶液的pH=10,推知BOH溶液存在BOH?B++OH- |
| D、用0.2000mol?L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1mol?L-1),至中性时,溶液中的酸恰好被完全中和 |


科目:高中化学 来源: 题型:
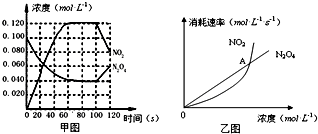
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 与
与 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 |
| B、SiH4、PH3、HCl的稳定性逐渐增强 |
| C、氧化铁的化学式:FeO |
D、Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体X为SO2 |
| B、气体X为H2 |
| C、气体X为SO2和H2的混合物 |
| D、气体X中SO2和H2的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、发酵粉能使烘焙出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
| C、针对甲型H1N1流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
| D、加碘食盐中添加碘酸钾而不是碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| A、一定没有亚硫酸钡沉淀 |
| B、一定有硫酸钡沉淀生成 |
| C、得到的沉淀是亚硫酸钡和硫酸钡的混合物 |
| D、逸出的气体是氨气和二氧化硫气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com