
| A. | 20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>?c(Cl-)>c(CH3COOH)>?c(H+) | |
| B. | 0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中:2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 将amol/L氨水与0.01mol/L 盐酸等体积混合,若反应完全时溶液中 c(NH4+)=c(Cl-),则NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
分析 A、20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合生成等物质的量浓度的醋酸、醋酸钠和氯化钠,而后溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度;
B、根据电荷守恒分析解答;
C、因为含等物质的量的NaHC2O4和Na2C2O4的溶液,设两者的物质的量均为1mol,根据钠与草酸根所有存在形式之比为3:2;
D、若反应完全时溶液中 c(NH4+)=c(Cl-)=$\frac{0.01}{2}$mol/L,根据电荷守恒可知c(OH-)=c(H+)=10-7mol/L,根据氨水中氮守恒可知:氨水的浓度为:$\frac{a-0.01}{2}$mol/L,所以则NH3•H2O的电离常数Kb=$\frac{\frac{0.01}{2}×1{0}^{-7}}{\frac{a-0.01}{2}}$.
解答 解:A、20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合生成等物质的量浓度的醋酸、醋酸钠和氯化钠,而后溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,所以c(CH3COO-)>?c(Cl-)>c(CH3COOH)>?c(H+)>c(OH-),故A正确;
B、根据电荷守恒可知:2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故B错误;
C、因为含等物质的量的NaHC2O4和Na2C2O4的溶液,设两者的物质的量均为1mol,根据钠与草酸根所有存在形式之比为3:2,则2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故C正确;
D、若反应完全时溶液中 c(NH4+)=c(Cl-)=$\frac{0.01}{2}$mol/L,根据电荷守恒可知c(OH-)=c(H+)=10-7mol/L,根据氨水中氮守恒可知:氨水的浓度为:$\frac{a-0.01}{2}$mol/L,所以则NH3•H2O的电离常数Kb=$\frac{\frac{0.01}{2}×1{0}^{-7}}{\frac{a-0.01}{2}}$,所以Kb=$\frac{1{0}^{-9}}{a-0.01}$,故D正确;
故选:B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将一定质量t1℃的饱和溶液升温后,溶液浓度小于$\frac{{S}_{1}}{100+{S}_{1}}$×100% | |
| B. | 把t1℃时的饱和溶液升温到t2℃,需加入x固体(S2-S1)g才饱和 | |
| C. | 把t1℃和t2℃时x的两种饱和溶液各a g分别降温至t℃,所得溶液浓度相等 | |
| D. | 把t3℃时的饱和溶液(100+S3)g冷却到t2℃时,一定析出固体(S3-S2)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 种 | B. | 10种 | C. | 11 种 | D. | 12 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1+α)n | B. | $\frac{(1+α)n}{1-α}$ | C. | $\frac{(1-α)n}{1+α}$ | D. | (1+2α)n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
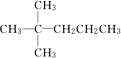 ,该烷烃分子的名称2,2-二甲基戊烷.
,该烷烃分子的名称2,2-二甲基戊烷.查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列有关化学用语或名称表达正确的是( )
A.亚硫酸的电离方程式:H2SO3 2H++SO
2H++SO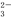
B.乙炔的分子结构模型示意图:
C.H2O2的电子式: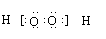
D. 的名称3-甲基-1-丁醇
的名称3-甲基-1-丁醇
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
强酸和强碱在稀溶液里反应的热化学方程式可表示为:
H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1
已知:CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l)ΔH=-Q2 kJ·mol-1
上述均是在溶液中进行的反应,Q1、Q2的关系正确的是( )
A.Q1=Q2=57.3 B.Q1>Q2>57.3 C.Q1<Q2=57.3 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com