
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
分析 A.原子半径越小,原子间形成的键长越短;
B.根据该分子是否是对称结构判断分子的极性;
C.如果元素的最外层电子数+元素的化合价的绝对值=8,该元素就达到8电子稳定结构,否则没有达到8电子稳定结构;
D、N原子最外层有5个电子,形成3个σ键.
解答 解:A.C原子的原子半径大于N原子的原子半径,所以CCl4中C-C1键键长比NC13中N-C1键键长,故A错误;
B.NC13的分子空间构型与氨分子相似,都是三角锥型结构,氨分子是极性分子,所以NCl3分子也是极性分子,故B错误;
C.NC13中N原子最外层电子数5+化合价的绝对值3=8,所以N原子达到8电子稳定结构;NC13中C1原子最外层电子数7+化合价的绝对值1=8,所以C1原子达到8电子稳定结构,故C正确;
D.N原子最外层有5个电子,形成3个σ键,含有1个孤电子对,故D错误.
故选C.
点评 本题考查共价键知识,为高频考点,明确熔沸点大小的判断方法、化合物中原子最外层电子数是否为8的判断方法、原子半径与键长的关系即可解答本题,难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
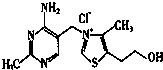
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
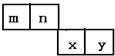 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: .
.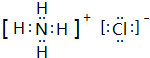 ,此物质在固态时属于离子晶体.
,此物质在固态时属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为纺锤形,能量也相等 | |
| D. | 氮原子的最外层电子的轨道表示式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ③
③ 、
、 .
.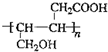 .
.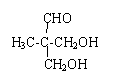 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com